
【题目】一种用草酸泥渣(含73.75%PbC2O4、24.24%PbSO4)制备PbCrO4的工艺流程如下:
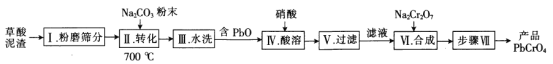
回答下列问题:
已知:①PbC2O4完全分解的化学方程式为![]() 。
。
②PbCrO4难溶于水。
(1)泥渣“粉磨筛分”的目的是___________________________________。
(2)用Na2CO3将PbSO4转化为PbCO3的目的是_______________________;若在水溶液中进行![]() ,该反应的平衡常数K=______________________________________[已知KSP(PbCO3)=6.4×10-14,KSP(PbSO4)=1.6×10-8]。
,该反应的平衡常数K=______________________________________[已知KSP(PbCO3)=6.4×10-14,KSP(PbSO4)=1.6×10-8]。
(3)步骤Ⅵ“合成”时发生反应的化学方程式为____________________。
(4)“步骤Ⅶ”包含的实验操作有___________________________________及干燥。
(5)某工厂用10t该草酸泥渣制备PbCrO4,最终得到9.69t产品,Pb元素的转化率为_______(精确到小数点后2位)。
【答案】使反应速率加快 将难以热分解的硫酸铅转化为易分解的碳酸铅; 2.5×105 2Pb(NO3)2+Na2Cr2O7+H2O=2PbCrO4↓+2NaNO3+2HNO3 过滤、洗涤 90.91%
【解析】
(1)泥渣“粉磨筛分”后,颗粒变小,与溶液充分接触效果好;
(2)PbSO4不溶于水,加热不分解,Na2CO3将PbSO4转化为PbCO3,不溶于水,且加热分解;
(3)滤液中的硝酸铅与重铬酸钠反应生成铬酸铅、硝酸钠和硝酸;
(4)固液分离,采用过滤、洗涤、干燥;
(5)转化率为实际产量/理论产量×100%。
(1)泥渣“粉磨筛分”后,颗粒变小,与溶液充分接触效果好,提高反应速率;
(2)PbSO4不溶于水,加热不分解,Na2CO3将PbSO4转化为PbCO3,不溶于水,且加热易分解;根据反应式可知,K=c(SO42-)/c(CO32-)=KSP(PbSO4)/KSP(PbCO3)=2.5×105;
(3)滤液中的硝酸铅与重铬酸钠反应生成铬酸铅、硝酸钠和硝酸,反应的方程式:2Pb(NO3)2+Na2Cr2O7+H2O=2PbCrO4↓+2NaNO3+2HNO3;
(4)PbCrO4难溶于水,则固液分离,采用过滤、洗涤、干燥,可得到纯净的PbCrO4;
(5)根据Pb元素守恒,10t草酸泥含有Pb的质量为10t×73.75%×207/295+10t×24.24%×207/303=6.831t,理论可生成PbCrO4的质量为6.831t×323/207=10.659t,实际生成9.69t,则转化率为9.69t/10.659t×100%=90.91%。


科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B. 电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)用单线桥表示下列反应中电子转移方向和数目:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O_____
(2)钙元素是人体必需的常量元素,所有的细胞都需要钙元素.测定人体血液中钙元素的含量常用到如下两个反应:①CaC2O4+H2SO4=H2C204+CaSO4②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O,上述反应②的还原剂是___;若收集到44.8mL(标准状况)的CO2时,消耗氧化剂___mol,有__mol电子发生转移,相当于测出含钙元素的质量是__g。
(3)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡 常数(25℃) | Ka=1.77×10-4 | Ka=4.0×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)室温下①0.1mol·L-1HCOONa,②0.1mol·L-1NaClO,③0.1mol·L-1Na2CO3,④0.1mol·L-1NaHCO3溶液的pH由大到小的关系为_______________________。
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为_______________________。
(3)下列离子方程式正确的是___________(填字母)。
A.2ClO-+H2O+CO2=2HClO+CO32-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.H2SO3+=2HCOO-=2HCOOH+SO32-
D.Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
(4)某温度(T℃)下的溶液中,c(H+)=10-xmol·L-1,c(HO-)=10-ymol·L-1,x与y的关系如图所示。
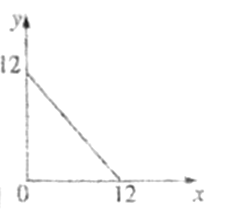
①此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为____________。
②在此温度下,0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1mol·L-1的Ba(OH)2 | 10 | 10 | 10 | 10 |
0.1mol·L-1的NaHSO4 | 5 | 10 | 15 | 20 |
按丁方式混合后,所得溶液显____________(填“酸”“碱”或“中”)性,写出按乙方式混合后,反应的离子方程式:______________。按甲方式混合后,所得溶液的pH为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示的转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
![]()
A.X可能为Al或Cl2
B.Y一定为NaOH(aq)
C.N一定是HCl(aq)
D.Q、Z中的一种必为Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。
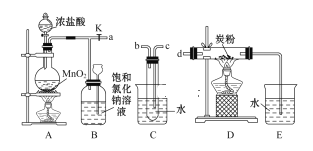
(1)要将C装置接入B和D之间,正确的接法是a→________→________→________。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为____________________。
(3)D处反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是____________________,B的作用是_______。
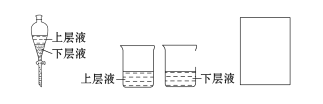
(4)用量筒量取20 mL E装置中溶液,倒入已检查完气密性良好的分液漏斗中,然后再注入10 mL CCl4,盖好玻璃塞,振荡,静置于铁架台上(如图),等分层后取上层液和下层液,呈黄绿色的是________(填“上层液”或“下层液”),再装入如图所示的烧杯中,能使有色布条褪色的是___(填“上层液”或“下层液”)。
(5)在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由并在方框中画出改进后的装置图:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示转化关系(部分产物已略去)。下列说法正确的是( )
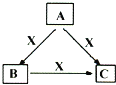
A. 若X为KOH溶液,则A可能为Al
B. 若X为Fe,则C可能为Fe(NO3)2溶液
C. 若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2
D. 若X为O2,则A可为有机物乙醇,也可为非金属单质硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是
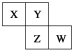
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性Z比W强
C. Y的气态氢化物的稳定性较Z的弱
D. 四种元素的单质中,Z的熔、沸点最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是一种非常重要的化工原料,在玻璃、肥料、合成洗涤剂等工业中有着广泛的应用。工业上“候氏制碱法”以NaCl、NH3、CO2及水等为原料制备纯碱,其反应原理为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。生产纯碱的工艺流程示意图如下:
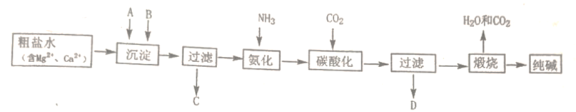
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。A_____________,B_____________。
(2)碳酸化后过滤,滤液D最主要的成分是__________(填写化学式),检验这一成分的阴离子的具体方法是: ______。
(3)该工艺流程中可回收再利用的物质是_______。
(4)产品纯碱中含有碳酸氢钠,如果取m1 kg纯碱加热分解后剩余固体质量为m2 kg,纯碱中碳酸氢钠的质量分数可表示为:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com