
【题目】在2L的密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)已知:K300℃>K350℃,则该反应正反应是_______热反应。
(2)如图表示NO2的变化的曲线是_________。用O2表示从0~2 s内该反应的平均速率v=_______ mol·L-1·s-1。
(3)能说明该反应已达到平衡状态的是____。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是____。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
【答案】放 b 1.5×10-3 bc c
【解析】
(1)根据温度对化学平衡移动的影响,结合化学平衡常数大小判断反应的热效应;
(2)根据表中数据计算平衡时NO、NO2的物质的量,结合容器的体积判断物质的平衡浓度,从而确定NO2的曲线;先计算2s内NO的浓度变化计算从02s内该反应的平均速率v(NO),然后根据同一反应中同一段时间内各物质的反应速率之比等于其计量数之比计算v(O2);
(3)根据反应达到平衡状态时各种物质的物质的量、浓度及物质的含量不变判断平衡状态;
(4)根据平衡移动原理分析。
(1)化学平衡常数K300℃>K350℃,说明升高温度,化学平衡逆向移动,由于在其他条件不变时,升高温度,化学平衡向吸热反应方向移动,逆反应方向为吸热反应,则该反应正反应是放热反应。
(2)根据表中数据知,达到平衡状态时n(NO)=0.007mol,则参加反应的 n(NO)=(0.020-0.007)mol=0.013mol,反应开始时c(NO2)=0,根据N原子守恒可知,生成的n(NO2)=0.013mol,c(NO2)= 0.013mol ÷2L =0.0065mol/L;所以表示NO2的变化的曲线是b;从02s内该反应的平均速率v(NO)= 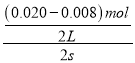 =0.003mol/(L·s),同一反应中同一段时间内各物质的反应速率之比等于其计量数之比,则v(O2)=
=0.003mol/(L·s),同一反应中同一段时间内各物质的反应速率之比等于其计量数之比,则v(O2)=![]() v(NO)= 0.0015mol/(L·s)= 1.5×10-3 mol/(L·s);
v(NO)= 0.0015mol/(L·s)= 1.5×10-3 mol/(L·s);
(3)a.无论反应是否达到平衡状态都存在v(NO2)=2v(O2),不能据此判 断平衡状态,a错误;
b.反应前后气体物质的量改变,则容器压强改变,当容器内压强保持不变时,正、逆反应速率相等,反应达到平衡状态,b正确;
c.v逆(NO)=2v正(O2),正、逆反应速率相等,反应达到平衡状态,c正确;
d.无论反应是否达到平衡状态,容器内密度始终保持不变,不能据此判断平衡状态,d错误; 故合理选项是bc;
(4)a.及时分离出NO2 气体,生成物浓度减小,则化学反应速率减小,a错误;
b.适当升高温度,增大活化分子百分数,化学反应速率增大,由于该反应的正反应为放热反应,升高温度,平衡逆向移动,b错误;
c.增大O2的浓度,增大单位体积内活化分子个数,化学反应速率增大,由于O2是反应物,增大反应物的浓度,平衡正向移动,c正确;
d.选择高效催化剂,增大活化分子百分数,化学反应速率增大,但催化剂不能使化学平衡发生移动,d错误;
故合理选项是c。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
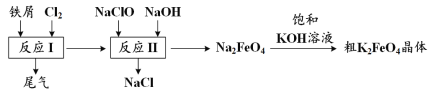
下列叙述不正确的是
A.用K2FeO4对饮用水杀菌消毒的同时,还产生Fe(OH)3胶体吸附杂质净化水
B.用FeCl2溶液吸收反应I中尾气后可再利用
C.反应II中氧化剂与还原剂的物质的量之比为3∶2
D.该生产条件下,物质的溶解性:Na2FeO4< K2FeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气、铝、铁都是重要的还原剂,已知下列反应的热化学方程式,下列关于反应的焓变判断正确的是
2H2(g)+O2(g)===2H2O(g) △H1
3H2(g)+Fe2O3(s)===2Fe (s)+ 3H2O(g) △H2
2Fe(s)+ 3/2O2(g)===Fe2O3(s) △H3
2Al(s)+3/2O2(g)===Al2O3(s) △H4
2Al(s)+ Fe2O3(s)===Al2O3(s)+2Fe(s) △H5
A. △H1<0;△H3>0 B. △H5<0;△H4<△H3
C. △H1=△H2+△H3 D. △H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅酸(H2SiO3)是一种难溶于水的弱酸,从溶液中析出时常形成凝胶状沉淀。实验室常用Na2SiO3溶液制备硅酸。某小组同学进行了如下实验:下列结论不正确的是( )
编号 | Ⅰ | Ⅱ |
实验 |
|
|
现象 | a 中产生凝胶状沉淀 | b 中凝胶状沉淀溶解,c 中无明显变化 |
A.Na2SiO3溶液一定显碱性
B.由Ⅰ能说明酸性H2CO3>H2SiO3
C.由Ⅱ可知,同浓度时Na2CO3溶液的碱性强于NaHCO3溶液
D.向Na2SiO3溶液中通入少量CO2,发生反应:SiO32-+CO2+H2O=CO32-+H2SiO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离常数如下图中a、b两条曲线所示,曲线中的点都符合c(H+)×c(OH-)=常数。下列说法正确的是
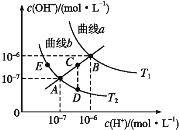
A. 图中温度T2>T1
B. 曲线a、b均代表纯水的电离情况
C. 图中五点的KW的关系:B>C>A>D=E
D. 若处在B点时,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度(mol/L) | 体积/mL | 浓度(mol/L) | 体积/mL | ||
① | 0.10 | 2.0 | 0.01 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.01 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.01 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:n(H2C2O4)∶n(KMnO4) ______________。
(2)探究温度对化学反应速率影响的实验编号是_______ (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是 ________.
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在正是全球抗击新冠病毒的关键时期,专家指出磷酸氯喹对治疗新冠病毒感染有明显效果,磷酸氯喹的分子结构如图所示,下列关于该有机物的说法正确的是( )

A.该有机物的分子式为:C18H30N3O8P2Cl
B.该有机物能够发生加成反应、取代反应、不能发生氧化反应
C.该有机物苯环上的1-溴代物只有2种
D.1mol该有机物最多能和8molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中,反应aA(g)+bB(g)![]() cC(g)+dD(g)达平衡时,B的浓度为0.6mol/L,若保持温度不变,将容器的容积扩大到原来的3倍,达新平衡时B的浓度降为0.3mol/L.下列判断正确的是
cC(g)+dD(g)达平衡时,B的浓度为0.6mol/L,若保持温度不变,将容器的容积扩大到原来的3倍,达新平衡时B的浓度降为0.3mol/L.下列判断正确的是
A. a+b<c+d
B. 平衡向正反应方向移动
C. D的体积分数减小
D. 达到新平衡时,A、B的浓度减小,C、D浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解煤浆液的方法制H2的反应为C(s)+2H2O(l)=CO2(g)+2H2(g)。现将一定量的1mol/LH2SO4溶液和适量煤粉充分混合,制成含碳量为0.02g/mL~0.12g/mL的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极)。下列说法错误的是
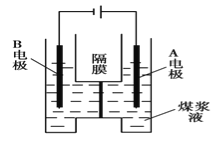
A. A极是阳极,B极为阴极
B. A极的电极反应式为C+2H2O-4e-=CO2↑+4H+
C. B极的电极反应式为2H++2e-=H2↑
D. 电解一段时间后,煤浆液的pH增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com