
【题目】有五种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
E | L层上有2对成对电子 |
请根据表中信息填空:
(1)A原子的核外电子排布式为___________。
(2)B元素在周期表中的位置:__________________;离子半径:B___ A(填“大于”或“小于”)
(3)C原子的价电子排布图是___________,其原子核外有__________个未成对电子,能量最高的电子为___________轨道上的电子,其轨道呈___________形。
(4)D原子的电子排布式为___________。D-的结构示意图是________________
(5)C、E元素的第一电离能的大小关系是___________(用元素符号表示)。
(6)已知CD3分子中D元素为+1价,则C、D的电负性大小关系是________________(用元素符号表示),CD3与水反应后的产物是__________和__________。
【答案】1s22s22p63s1 第三周期第IIIA族 小于 ![]() 3 2p 哑铃 1s22s22p63s23p5
3 2p 哑铃 1s22s22p63s23p5 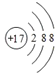 N>O N>Cl HClO NH3
N>O N>Cl HClO NH3
【解析】
短周期元素中,A是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂,则A为Na;B与A同周期,其最高价氧化物的水化物呈两性,则B为Al;C元素的气态氢化物极易溶于水,可用作制冷剂,则C为N元素;D是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,则D为Cl,E的L层上有2对成对电子,则E为O,据此解答。
短周期元素中,A是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂,则A为Na;B与A同周期,其最高价氧化物的水化物呈两性,则B为Al;C元素的气态氢化物极易溶于水,可用作制冷剂,则C为N元素;D是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,则D为Cl,E和L层上有2对成对电子,则E为O。
(1)A为Na,其核外电子排布式为1s22s22p63s1;
(2)B为Al,位于周期表中第三周期第IIIA族;Na+与Al3+核外电子排布相同,核电荷数Al3+大于Na+,故r(Al3+)<r(Na+),故答案为:小于;
(3)C为N元素,原子的价电子排布图为![]() ,其原子核外有3个未成对电子;能量最高的电子为2p轨道上的电子,其轨道呈哑铃形;
,其原子核外有3个未成对电子;能量最高的电子为2p轨道上的电子,其轨道呈哑铃形;
(4)D为Cl,电子排布式为1s22s22p63s23p5;D-的结构示意图是 ;
;
(5)C、E分别为N和O,由于Np轨道上半充满,故第一电离能反常的升高,故第一电离能的大小关系是N>O;
(6)已知NCl3分子中N为-3价,Cl为+1价,则电负性大小关系是N>Cl,NCl3与水反应后的产物是HClO和NH3。


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:
【题目】(I)短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
W | X | |||
Y | Z |
(1)Z在元素周期表中的位置______________。
(2)X的最简单氢化物的电子式为______。
(3)Y单质与NaOH溶液反应的离子方程式为:________。工业生产Y单质的化学方程式为__________。
(4)向盛有3 mL鸡蛋清溶液的试管里滴入几滴W的最高价氧化物的水化物浓溶液,实验现象为_________。
(II)甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g)ΔH1
CH3OH(g)ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH3
CO(g)+H2O(g)ΔH3
回答下列问题:已知反应①中的相关的化学键键能数据如表:
化学键 | H—H | C—O |
(CO中的化学键) | H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(5)由此计算ΔH1=__kJ·mol-1,已知ΔH2=-58kJ·mol-1,则ΔH3=__kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如下图所示,则原溶液中Al2(SO4)3和MgSO4的物质的量之比为
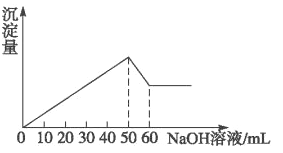
A. 1 :2B. 3 : 1C. 3 : 2D. 2 : 1
查看答案和解析>>
科目:高中化学 来源: 题型:
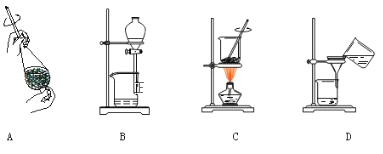
【题目】实验室制取乙酸乙酯,如图所示实验装置:

请回答下列问题:
(1)能完成本实验的装置是 __________________(从甲、乙、丙中选填)
(2)试管B中装入的液体为 ______________。
(3)制取乙酸乙酯时加入试剂顺序为_____________________,发生反应的化学方程式为 __________________________________________。
(4)从制备乙酸乙酯所得的混合物中分离、提纯乙酸乙酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是___________(选填答案编号)。
(5)用30g乙酸和40g乙醇反应,可以得到37.4g乙酸乙酯,则该实验的产率(产率指的是某种生成物的实际产量与理论产量的比值)是 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中的中心原子杂化轨道的类型相同的是( )
A. SO3与SO2 B. BF3与NH3 C. BeCl2与SCl2 D. H2O与SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列有关说法正确的是
A. 6.0g甲醛(HCHO)和醋酸的混合物中含有的原子总数为0.8NA
B. 1LpH =1的H2SO4溶液中所含的H+数目为0.2NA
C. 标准状况下,22.4L的辛烷完全燃烧生成的CO2分子数为8NA
D. 常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×109NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据地球化学分析,地壳中存在量较大的9种元素含量如图所示(含量最高的四种元素用字母代号表示)。下列说法正确的是( )
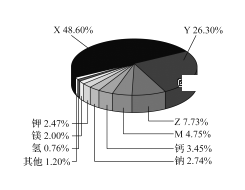
A. X为硅元素,M为铁元素
B. 地壳中有游离态的Y元素和M元素
C. Z和M的氧化物均属于碱性氧化物
D. Z的单质通过置换反应可制取M的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷及含磷化合物是重要的化工原料,广泛应用于洗涤剂、农药、医药、水处理等行业回答下列问题:
(1)基态P原子的轨道表示式为 ___(填字母)。
a.[Ne]![]() b.[Ne]
b.[Ne]![]()
c.[Ne]![]() d.[Ne]
d.[Ne]![]()
(2)黑磷是磷的一种同素异形体,与石墨烯类似,其晶体结构片段如图所示:
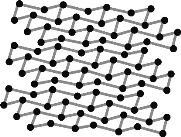
其中最小的环为___元环,每个环平均含有___个P原子。
(3)杀虫剂敌敌畏是有机磷化合物,其结构简式如图所示,其中C原子的杂化方式为____,甲基得一个电子后为CH3-,其空间构型为_____。
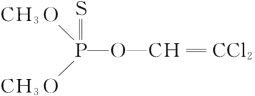
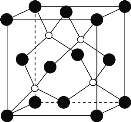
(4)磷化硼(BP)是一种超硬耐磨涂层材料,晶体中磷原子作面心立方最密堆积,硼原子填入四面体空隙中。
①PH3、NH3、BP三种物质的熔沸点由大到小的顺序为_____。
②磷化硼晶胞结构如图所示,晶胞参数a=b=c=478pm,α=β=γ=90°,则磷化硼的密度是___g·cm-3。(列出计算表达式,设阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下对反应的化学方程式,并注明反应类型:
(1)乙醇制乙烯:_________________,反应类型:_________________。
(2)乙醇与浓氢溴酸反应:_________________,反应类型_________________。
(3)苯酚与浓溴水反应:_________________,反应类型_________________。
(4)乙醛与银氨溶液反应:_________________,反应类型_________________。
(5)乙醛与新制氢氧化铜悬浊液反应:_________________,反应类型_________________。
(6)乙酸乙酯与氢氧化钠溶液反应:_________________,反应类型_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com