
【题目】25℃时,在含有PbI2固体的饱和溶液中存在着平衡PbI2(s)![]() Pb2+(aq)+2I(aq),加入KI固体,下列说法正确的是( )
Pb2+(aq)+2I(aq),加入KI固体,下列说法正确的是( )
A.溶液中Pb2+和I的浓度都增大B.溶度积常数Ksp增大
C.沉淀溶解平衡向右移动D.溶液中Pb2+的浓度减小
科目:高中化学 来源: 题型:
【题目】阳离子交换膜电解槽运用到氯碱工业,使产品的纯度大大提高,主要归功于阳离子交换膜的严格把关,它只允许阳离子自由通过,其工作原理如图所示。

(1)在氯碱工业中电解饱和食盐水制备氢气、氯气和氢氧化钠溶液时,饱和食盐水的入口应该是______(填“C”或“D”)。
(2)该装置也可用于物质的提纯,工业品氢氧化钾的溶液中含有某些含氧酸根杂质(如SO42-),可以用阳离子交换膜电解槽电解提纯。除去杂质后氢氧化钾溶液从液体出口_________(填“A”或“B”)导出。
(3)阳离子交换膜的诞生极大促进了电解工业的发展,我们不妨大胆设想,假设阴离子交换膜也已经诞生,同时使用阳离子交换膜和阴离子交换膜电解硫酸钠溶液,可以同时制备产品氢气、氧气、氢氧化钠溶液和硫酸溶液四种物质。某同学设计了如图所示的装置,请你指出硫酸钠溶液的入口是_______(填“C”“G”或“D”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷酸![]() 、亚砷酸
、亚砷酸![]() 是两种弱酸。回答下列问题:
是两种弱酸。回答下列问题:
(1)常温下,向![]() 溶液中滴加
溶液中滴加![]() 溶液,混合溶液中由水电离的
溶液,混合溶液中由水电离的![]() 与KOH溶液的体积之间的关系如图所示。
与KOH溶液的体积之间的关系如图所示。

![]() 点对应溶液的pH________
点对应溶液的pH________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() __________。
__________。
![]() 在一定温度下,向某容器中加入一定量的
在一定温度下,向某容器中加入一定量的![]() 、
、![]() 和NaOH溶液,发生反应:
和NaOH溶液,发生反应:![]() ,
,![]() 的转化率
的转化率![]() 与时间的关系如图所示,测得F点对应溶液中
与时间的关系如图所示,测得F点对应溶液中![]() 、
、![]() ,且溶液
,且溶液![]() 。
。

![]() 点:
点:![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”,下同
”,下同![]() ;E点的
;E点的![]() ______G点的
______G点的![]() 。
。
![]() 下列情况表明该反应达到平衡状态的是__________
下列情况表明该反应达到平衡状态的是__________![]() 填字母
填字母![]() 。
。
![]()
![]() 溶液颜色不再变化
溶液颜色不再变化
![]() 溶液的pH不再变化
溶液的pH不再变化 ![]() 溶液中
溶液中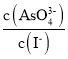 不再变化
不再变化
![]() 在该条件下,上述反应的平衡常数
在该条件下,上述反应的平衡常数![]() ____________
____________![]() 用含m的代数式表示
用含m的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体.合成肉桂酸甲酯的工业流程如图所示:
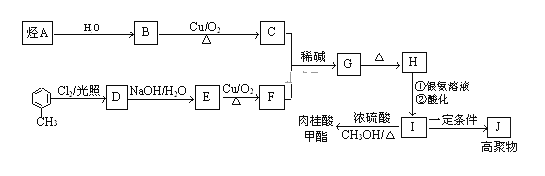
已知:I.醛与醛能发生反应,原理如下:![]() +CH3CHO
+CH3CHO RCH=CH2CHO
RCH=CH2CHO
Ⅱ.烃A在标准状况下的密度为1.25g/L。
请回答:
(1)化合物H中的官能团为__。
(2)A的结构简式为__,F的结构简式为__。
(3)G→H的反应类型为__。
(4)写出B→C的化学反应方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH—ΔH>0,下列叙述正确的是( )
H++OH—ΔH>0,下列叙述正确的是( )
A.向水中加入氢氧化钠,平衡逆向移动,c(H+)降低,c(OH―)增大
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大
C.向水中加入少量固体CH3COOH,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,c(H+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组以一种工业废渣(主要成分为MgCO3、MgSiO3和少量SiO2、Fe的氧化物)为原料制备碳酸镁晶体(MgCO33H2O)。实验过程如下:

下列说法不正确的是( )
A.为了加快酸溶速率,可将原料进行研磨并适当提高反应温度
B.滤渣的主要成分是H2SiO3和SiO2
C.萃取后,可用KSCN溶液检验水相中是否含有Fe3+
D.萃取后,往水溶液中加入适量的Na2CO3,经过加热蒸发,可得到碳酸镁晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下xA+yB![]() zC达到平衡时,请填写:
zC达到平衡时,请填写:
①若A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z关系是___。
②已知B、C是气体,现增加A的物质的量,平衡不移动,说明A是___(填状态)。
③若容器容积不变,加入气体B,气体A的转化率___(填“增大”“减小”或“不变”)。
④若加热后,C的百分含量减小,则正反应是___反应(填“放热”或“吸热”)。
⑤和原平衡相比,加催化剂达到平衡时,气体A的转化率___(填“增大”“减小”或“不变”)。
⑥若容器容积不变,且A、B、C都是气体,向容器中充入稀有气体,则___。
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不移动 D.反应停止
(2)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
①从反应开始到5min,用一氧化碳表示的平均反应速率v(CO)=____。

②下列说法正确的是___(填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
③甲醇作为一种燃料还可用于燃料电池。在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的负极反应式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃复分解反应可形象地描述为交换舞伴(如图所示):

烯烃复分解反应中的催化剂是金属卡宾(如CH2=M),金属卡宾与烯烃分子相遇后,两对舞伴会暂时组合起来,手拉手跳起四人舞蹈。随后它们“交换舞伴”,组合成两个新分子,其中一个是新的烯烃分子,另一个是金属原子和它的新舞伴。后者会继续寻找下一个烯烃分子,再次“交换舞伴”。根据以上信息进行判断,如果把C6H5CH2CH=CH2与CH2=M在一定条件下混合反应,下列产物不可能存在的是 ( )
A. C6H5CH2CH=M B. CH2=CH2
C. C6H5CH2CH2C6H5 D. C6H5CH2CH=CHCH2C6H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题:
(1)乙烯的电子式_________________。
(2)![]() 的分子式_________________。
的分子式_________________。
(3)![]() 的键线式___________________。
的键线式___________________。
(4)![]() 的系统命名为__________________。
的系统命名为__________________。
(5)分子式为C8H8O,遇FeCl3溶液显紫色且苯环上还有1个烃基的同分异构体有___种。
(6)C4H10O的同分异构体中,属于醇类且含有“手性碳原子”的结构简式为_________。
(7)CH2=CH-CH3加聚产物是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com