
【题目】下列有关金属的说法正确的是( )
A. Na久置于空气中最终生成NaHCO3
B. Mg比Al活泼,更易与NaOH溶液反应生成H2
C. 水蒸气通过灼热的铁粉有红棕色固体生成
D. 多数合金比各成分金属熔点低,硬度大
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如右图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是( )

A. 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O![]()
B. 晶体中每个K+周围有8个O![]() ,每个O
,每个O![]() 周围有8个K+
周围有8个K+
C. 晶体中与每个K+距离最近的K+有8个
D. 晶体中与每个K+距离最近的K+有6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A的各级电离能数据如下:
I1 | I2 | I3 | I4 | I5 | I6 | |
I/(kJ·mol-1) | 568 | 1517 | 9745 | 10978 | 13931 | 17978 |
则元素A常见价态是( )
A.+1B.+2C.+3D.+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,是吸热反应,也是氧化还原反应的是( )
A. Ba(OH)2﹒8H2O与NH4CI晶体混合 B. 盐酸与NaOH溶液混合
C. 炽热的碳与二氧化碳反应 D. Al片投入盐酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
铬、锰、铁、钴、镍等过渡金属元索的单质及其化合物在工农业、国防、科技等领域具存广泛应用。
(1)基态Cr原子中有_________个未成对电子,最外层电子所占用能级的电子云形状为_______。
(2)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关,一般地,为d0或d10排布时,无颜色;为d1d9排布时,有颜色。则:[Mn(H2O)6]2+ ________(填“无”或“有”)颜色。
(3)不同温度下,铁单质晶胞的两种堆积方式如图所示

①图1和图2中Fe原子的配位数分别为_______________和________________。
②若图2的晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶胞中两个最近的Fe原子之间的距离为__________pm。(用含ρ、NA的代数式表示)
(4)已知MgO与NiO的晶体结构(如图3)相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO__________NiO(填“>”“<”或“=”),理由是_______________。若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______________。
(5)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图4),已知O2-的半径为ɑ m,每平方米面积上分散的该晶体的质量为_________g。(用含ɑ、NA的代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
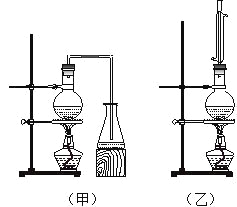
【题目】实验室制取乙酸丁酯的实验装置有如右下图所示两种装置供选用。其有关物质的物理性质
如下表:
乙酸 | 1-丁醇 | 乙酸丁酯 | |
熔点(℃) | 16.6 | -89.5 | -73.5 |
沸点(℃) | 117.9 | 117 | 126.3 |
密度(g/cm3) | 1.05 | 0.81 | 0.88 |
水溶性 | 互溶 | 可溶(9g/100g水) | 微溶 |
(1)制取乙酸丁酯的装置应选用_______(填“甲”或“乙”)。不选另一种装置的理由是 。
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式): 、 。
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,可采取的措施是 。
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是___________(选填答案编号)。
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须 ;某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还可能 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、
CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
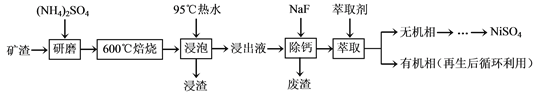
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成
NiSO4、Fe2(SO4)3。
锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是___________________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为____________________。
“浸渣”的成分除Fe2O3、FeO(OH)外还含有________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的_______倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为___________________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如下图所示,V0/VA的最佳取值是______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com