
【题目】A、B、C、D、E、F是六种原子序数依次增大短周期元素;A元素的原子是周期表中半径最小的;B元素的最外层电子数是内层的2倍;D元素的最外层电子数是其次外层电子数的3倍;E与A同主族;F的氧化物是形成酸雨的主要成分之一。请回答下列问题:
(1)F元素的名称________
(2)A、D、E形成的化合物的类型是______ (填“离子化合物”“共价化合物”)
(3)用电子式表示BD2的形成过程____________
(4)B、C的最高价氧化物的水化物的酸性________>________(填化学式)
【答案】硫 离子化合物 ![]() +
+![]() +
+![]() →
→![]() HNO3 H2CO3
HNO3 H2CO3
【解析】
A、B、C、D、E、F是六种原子序数依次增大短周期元素;A元素的原子是周期表中半径最小的,则A为H元素;B元素的最外层电子数是内层的2倍,则B为C元素;D元素的最外层电子数是其次外层电子数的3倍,则C为N元素,D为O元素;E与A同主族,则E为Na元素;F的氧化物是形成酸雨的主要成分之一,则F为S元素,据此分析结合元素性质解答。
(1)F为S元素,元素的名称硫
(2)A、D、E分别为H、O、Na元素,形成的化合物为氢氧化钠,由钠离子和氢氧根离子构成,属于离子化合物;
(3)B为C元素,D为O元素,BD2为CO2,电子式表示的形成过程为![]() +
+![]() +
+![]() →
→ ![]() ;
;
(4)B为C元素,C为N元素,非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性:N>C,则HNO3>H2CO3。


科目:高中化学 来源: 题型:
【题目】海水综合利用要符合可持续发展的原则,其联合工业体系(部分)如图所示,下列说法不正确的是 ( )
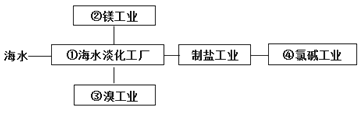
A.①中可采用蒸馏法
B.②中将MgCl2溶液蒸干即可得到无水MgCl2
C.③中提溴涉及到氧化还原反应
D.④的产品可生产盐酸、漂白液等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是
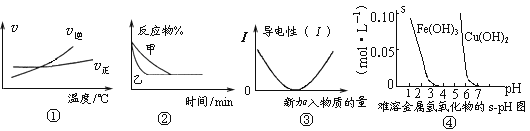
A. 根据图①可判断可逆反应“A2(g)+3B2(g)![]() 2AB3(g)”的ΔH>0
2AB3(g)”的ΔH>0
B. 图②表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C. 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D. 根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有机物 的叙述中,不正确的是( )
的叙述中,不正确的是( )
A. 它难溶于水,但易溶于苯
B. 该物质含苯环的同分异构体(不包括它本身)共有5种
C. 它会使酸性高锰酸钾溶液褪色
D. 一定条件下以和浓硝酸、浓硫酸的混合物发生硝化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】交联聚合物P的结构片段如图所示。下列说法不正确的是(图中![]() 表示链延长)
表示链延长)

A. 聚合物P中有酯基,能水解
B. 聚合物P的合成反应为缩聚反应
C. 聚合物P的原料之一丙三醇可由油脂水解获得
D. 邻苯二甲酸和乙二醇在聚合过程中也可形成类似聚合物P的交联结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:
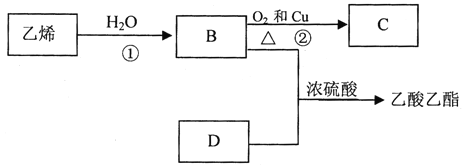
(1)乙烯的结构简式为_________。
(2)C中含官能团____;D中含官能团____。
(3)写出反应③的化学方程式________,![]() (注明反应条件),反应类型为_____
(注明反应条件),反应类型为_____![]() 反应①的化学方程式为_____
反应①的化学方程式为_____ ![]() (不必写条件)
(不必写条件)
(4)下列关于乙醇的说法不正确的是_____ (选填字母)。
A.乙醇不能和酸性高锰酸钾溶液发生反应
B.交警用橙色的酸性重铬酸钾溶液检查司机是否酒后驾车
C.黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写错误的是
A. HCO3-的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. Cu2+的水解方程式:Cu2++2H2O![]() Cu(OH)2+2H+
Cu(OH)2+2H+
C. NH4+的水解方程式:NH4++2H2O![]() NH3·H2O+H3O+
NH3·H2O+H3O+
D. CaCO3的电离方程式:CaCO3![]() Ca2++CO32-
Ca2++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)羟基的电子式________;
(2)﹣C3H7结构简式:________、________;
(3)CH3C(CH3)2CH2C(CH3)3系统命名为________该烃一氯取代物有________种。
(4)支链只有一个乙基且相对分子质量最小的烷烃的结构简式________。
(5)键线式 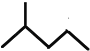 表示的分子式________。
表示的分子式________。
(6)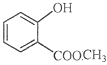 中含有的官能团的名称为________。
中含有的官能团的名称为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置进行中和热的测定。回答下列问题:
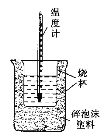
(1)该图中有两处未画出,它们是____________、____________。
(2)在操作正确的前提下提高中和热测定的准确性的关键是____________。
(3)如果用0.50 mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”将____________(填“偏大”、“偏小”或“不变”);原因是____________。
(4)乙醇是未来内燃机的首选环保型液体燃料。2.0g乙醇完全燃烧生成液态水放出59.43 kJ的热量,表示乙醇燃烧热的热化学方程式为____________________________。
(5)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2,其△H=__________kJ·mol-1。
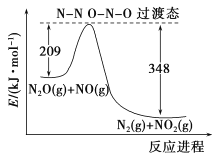
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com