
【题目】下列根据实验及现象得出的结论不正确的是
实验 | 现象 | 结论 | |
A |
| 试管(1)中紫色消失,试管(2)中紫色没有消失 | 甲苯中苯环使甲基的活性增强 |
B |
| 试管内壁有银镜生成 | X具有还原性,一定含有醛基 |
C |
| 先生成白色沉淀,滴加FeCl3溶液后,生成红褐色沉淀 | Fe(OH)3 是比Mg(OH)2 更难溶的电解质 |
D |
| 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到检流计的指针发生了偏转。
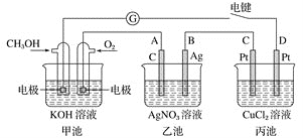
请回答下列问题:
(1)甲池为________(填“原电池”、“电解池”或“电镀池”),通入CH3OH一极的电极反应式为_____________________________________________________________;
(2)乙池中A(石墨)电极的名称为________(填“正极”、“负极”、“阴极”或“阳极”),总反应式为_________________________________________________________;
(3)当乙池中B极质量增加5.40 g时,甲池中理论上消耗O2的体积为________ mL(标准状况),丙池中________极析出________ g铜;
(4)若丙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将________(填“增大”、“减小”或“不变”);丙中溶液的pH将________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼![]() 又称联氨,是一种可燃性的液体,可用作火箭燃料。
又称联氨,是一种可燃性的液体,可用作火箭燃料。
![]() 已知在101kPa时,
已知在101kPa时,![]() 时,
时,![]() 在氧气中完全燃烧生成氮气和水,放出624kJ的热量,则
在氧气中完全燃烧生成氮气和水,放出624kJ的热量,则![]() 的燃烧热的热化学方程式是_____________。
的燃烧热的热化学方程式是_____________。
![]() 下图是一个电化学过程示意图。
下图是一个电化学过程示意图。

![]() 图中甲池是_________
图中甲池是_________![]() 填“原电池”或“电解池”
填“原电池”或“电解池”![]() ,其电解质溶液为KOH溶液,则该池电极M的电极反应式是_________________________。
,其电解质溶液为KOH溶液,则该池电极M的电极反应式是_________________________。
![]() 乙池中石墨电极2的电极反应式是_________________________。 当石墨电极2上生成
乙池中石墨电极2的电极反应式是_________________________。 当石墨电极2上生成![]() 气体时
气体时![]() 标准状况下
标准状况下![]() ,转移的电子的数目为_________,则甲池理论上消耗标标准状况下的空气是________
,转移的电子的数目为_________,则甲池理论上消耗标标准状况下的空气是________![]() 假设空气中氧气体积含量为
假设空气中氧气体积含量为![]() 。
。
![]() 传统制备肼的方法,是以NaClO氧化
传统制备肼的方法,是以NaClO氧化![]() ,制得肼的稀溶液。该反应的离子方程式是_________。
,制得肼的稀溶液。该反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池具有广阔的发展前途,科学家近年研制出一种微型的燃料电池,采用甲醇取代氢气做燃料可以简化电池设计,该电池有望取代传统电池。某学生在实验室利用碱性甲醇燃料电池电解Na2SO4溶液。
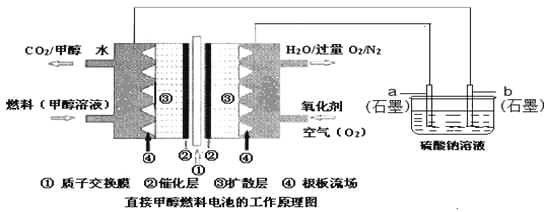
请根据图示回答下列问题:
(1)图中a电极是______(填“正极”、“负极”、“阴极”或“阳极”)。该电极上发生的电极反应式为_________________________________________。
(2)碱性条件下,通入甲醇的一极发生的电极反应式为____________________________。
(3)当消耗3.36 L氧气时(已折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是__。
(4)25℃、101kPa时,燃烧16g甲醇生成CO2和H2O(l),放出的热量为363.26kJ,写出甲醇燃烧的热化学方程式:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,下列说法正确的是( )
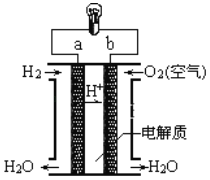
A.氢氧燃料电池的总反应化学方程式是2H2+O2=2H2OB.a极是正极
C.![]() 向正极移动D.阴极的电极反应式:O2+4H++4e-=2H2O
向正极移动D.阴极的电极反应式:O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中, a、b为石墨电极,通电一段时间后,b极附近显红色。下列说法不正确的是

A. b电极反应式为2H++2e-=H2↑B. a电极反应式为2Cl--2e-=Cl2↑
C. 铁电极反应式为Cu2++2e-=CuD. 铜电极反应式为4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列各小题:
Ⅰ.(1)理论上稀的强酸、强碱反应生成1molH2O(l)时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式__________________________。
(2)已知:乙苯催化脱氢制苯乙烯反应:![]() +H2(g)
+H2(g)
化学键 | C-H | C-C | C=C | H-H |
键能/kJmol-1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=_________kJmol-1。
Ⅱ.25℃时,部分物质的电离平衡常数如表所示,请回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为_____________________________。
(2)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知BaSO4(s)![]() Ba2+(aq)+SO42﹣(aq),25℃时Ksp=1.07×10﹣10,且BaSO4的溶解度随温度升高而增大.如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线,则下列说法不正确的是
Ba2+(aq)+SO42﹣(aq),25℃时Ksp=1.07×10﹣10,且BaSO4的溶解度随温度升高而增大.如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线,则下列说法不正确的是
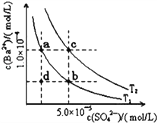
A. 温度为T1时,在T1曲线上方区域任意一点时,均有BaSO4沉淀生成
B. 蒸发溶剂可能使溶液由d点变为T1曲线上a、b之间的某一点
C. 升温可使溶液由b点变为d点
D. T2>25℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示的实验装置和方法进行实验,能达到目的的是( )
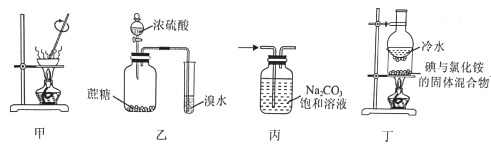
A.甲装置可将AlCl3溶液蒸干获得AlCl3晶体
B.乙装置可证明浓硫酸具有脱水性和氧化性
C.丙装置可除去CO2中的HCl
D.丁装置可将NH4Cl固体中的I2分离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com