
【题目】以铬铁矿(含FeO·Cr2O3、Al2O3、SiO2等)为原料制备二草酸铬钾的实验步骤如图:

回答下列问题:
(1)“熔融”的装置如图,坩埚W的材质可以是___(填“铁”“陶瓷”或“玻璃”);FeO·Cr2O3与KClO3及Na2CO3发生反应,生成Fe2O3、KCl、Na2CrO4和CO2的化学方程式为____。

(2)熔融后的固体中含Na2CrO4、Fe2O3、Na2SiO3、NaAlO2、KCl及NaFeO2等,步骤①的具体步骤为水浸,过滤,调pH为7~8,加热煮沸半小时,趁热过滤。第一次过滤滤渣中的主要成分为_____。
(3)步骤②需加入酸,则加入稀硫酸时发生反应的离子方程式为____。
(4)由步骤③可知,溶解度:Na2Cr2O7____(填“>”“<”或“══”)K2Cr2O7。
(5)步骤④包含的具体操作有___、___过滤并洗涤,经干燥得到K2Cr2O7晶体。(有关物质的溶解度曲线如图所示)

(6)步骤⑤需往两种固体混合物中加入一滴水及少量酒精研磨,所用的硅酸盐质仪器的名称是____。
(7)采用热重分析法测定K[Cr(C2O4)2]·nH2O样品所含结晶水数,将样品加热到80°C时,失掉全部结晶水,失重16.8%。K[Cr(C2O4)2]·nH2O晶体中n=____。
【答案】铁 6FeO·Cr2O3+12Na2CO3+7KClO3![]() 12Na2CrO4+3Fe2O3+7KCl+12CO2↑ Fe2O3和Fe(OH)3 2CrO42-+2H+
12Na2CrO4+3Fe2O3+7KCl+12CO2↑ Fe2O3和Fe(OH)3 2CrO42-+2H+![]() Cr2O72-+H2O > 加热浓缩 冷却结晶 研钵 3
Cr2O72-+H2O > 加热浓缩 冷却结晶 研钵 3
【解析】
(1)高温下陶瓷或玻璃中的SiO2会与NaOH及Na2CO3发生反应;由流程中的产物及已知条件,根据质量守恒写出反应方程式。
(2)第一次过滤的滤渣为熔渣中的Fe2O3以及反应NaFeO2+2H2O=Fe(OH)3+NaOH生成的Fe(OH)3。
(3)酸化时,CrO42-→Cr2O72-,由此写出离子方程式。
(4)步骤③利用了复分解反应将溶解度大的Na2Cr2O7转化为溶解度小的K2Cr2O7沉淀。
(5)依据溶解度曲线,采用蒸发浓缩、冷却结晶,过滤并洗涤沉淀的方法进行分离。
(6)实验室研磨固体时,所用硅酸盐质仪器为研钵。
(7)K[Cr(C2O4)2]·nH2O的相对分子质量为267+18n,失掉全部结晶水,失重16.8%,即结晶水的质量分数为16.8%,列式计算。
(1)高温下陶瓷或玻璃中的SiO2会与NaOH及Na2CO3发生反应;由流程中的产物及已知条件可知反应方程式为6FeO·Cr2O3+12Na2CO3+7KClO3![]() 12Na2CrO4+3Fe2O3+7KCl+12CO2↑。
12Na2CrO4+3Fe2O3+7KCl+12CO2↑。
(2)第一次过滤的滤渣为熔渣中的Fe2O3以及反应NaFeO2+2H2O=Fe(OH)3+NaOH生成的Fe(OH)3。
(3)酸化时,CrO42-→Cr2O72-,离子方程式为2CrO42-+2H+![]() Cr2O72-+H2O。
Cr2O72-+H2O。
(4)步骤③利用了复分解反应Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,将溶解度大的Na2Cr2O7转化为溶解度小的K2Cr2O7沉淀。
(5)依据溶解度曲线,采用蒸发浓缩、冷却结晶,过滤并洗涤沉淀的方法进行分离。
(6)实验室研磨固体时,所用硅酸盐质仪器为研钵。
(7)K[Cr(C2O4)2]·nH2O的相对分子质量为267+18n,由题意知![]() ,解得:n=3。
,解得:n=3。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用如图所示装置探究苯与溴的反应原理。

请回答下列问题:
(1) 仪器M的名称为__________。
(2) 装置Ⅰ中铁丝除做催化剂外,还可控制反应的进行,使反应停止的操作是__________。
(3)装置Ⅰ中生成溴苯的化学方程式为______________________________。
(4)冷凝管的进水口为________((填“a”或“b”),下同;其作用是_____________;
(5)能验证苯与液溴发生的是取代反应的现象是______________;
(6)装置Ⅱ中,若撤去装有苯的小试管,将导管直接插入硝酸银溶液,对实验目的达成会产生什么影响__________________________
(7)装置III中的离子反应方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸钠是家用消毒剂的有效成分。实验室制备次氯酸钠的装置如下图甲所示。

(1)装置C中生成各物质的物质的量和溶液的温度随时间的变化如图乙所示。t1分钟后所发生主要反应的化学方程式为________________________。
(2)如果要减少NaClO3的生成,可以采取的方法是_________、___________(填两种)。
(3)由装置C中的溶液得到次氯酸钠样品。假设该次氯酸钠样品中混有的杂质为NaClO3或NaCl中的一种。称取2.0225 g样品于锥形瓶中,加水使其完全溶解,向溶液中加入200 mL 0.60 mol·L-1的FeSO4溶液(过量),充分反应。再向溶液中滴加0.50 mol·L-1的KMnO4溶液,恰好完全反应时消耗KMnO4溶液20.00 mL。请计算样品中NaClO的质量分数____________(写出计算过程)。
已知:H++ClO-+Fe2+→Cl-+Fe3++H2O
H++ClO3-+Fe2+→Cl-+Fe3++H2O
H++MnO4-+Fe2+→Mn2++Fe3++H2O(以上反应均未配平)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,在H2CO3溶液中逐滴加入NaOH溶液,溶液中H2CO3、HCO3-和CO32-的物种分布分数![]() (X)=
(X)=![]() 与pH的关系如图所示:
与pH的关系如图所示:

下列说法正确的是
A. 反应HCO3-![]() H++CO32-的lgK=-6.4
H++CO32-的lgK=-6.4
B. pH═8的溶液中:c(Na+)>c(HCO3-)
C. NaHCO3溶液中滴入少量盐酸至溶液显中性:c(Na+)═c(Cl-)
D. 向pH=6.4的溶液中滴加NaOH溶液至pH=8,主要发生的离子反应:HCO3-+OH-═CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为直流电源电解稀Na2SO4溶液的装置。通电一段时间后,在石墨电极a和b附近分别滴加一滴酚酞溶液。则下列有关说法中正确的是( )

A.a电极产生H2
B.两极产生的气体均有刺激性气味
C.通电一段时间后,稀Na2SO4溶液酸性增强
D.a电极附近呈无色,b电极附近呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20mL bmol·L﹣1KOH溶液中逐滴加入0.1mol·L﹣1醋酸溶液,溶液pH和加入醋酸的体积关系曲线如图所示,下列关系不正确的是
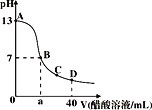
A. a=20
B. b=0.1
C. 在C点:c(CH3COO﹣)>c(K+)>c(H+)>c(OH﹣)
D. 在D点:c(CH3COO﹣)+c(CH3COOH)=2c(K+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子晶体晶胞的结构如图所示。X(●)位于立方体顶点,Y(○)位于立方体中心。试

(1)晶体中每个Y同时吸引着__个X,每个X同时吸引着__个Y,该晶体的化学式为____________。
(2)晶体中每个X周围与它最接近且距离相等的X共有___个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX是____。
(4)设该晶体的摩尔质量为Mg·mol-1,晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的X中心间距为___cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全国平板玻璃生产企业大气污染物年排放总量逐年增加,对氮氧化物(NOx)排放的控制与监测已刻不容缓。回答下列问题
(1)平板玻璃熔窑烟气中的NOx以温度型氮氧化物为主。其中NO在空气中容易被一种三原子气体单质氧化剂和光化学作用氧化成NO2,该氧化剂的分子式为___________。
(2)用CH4催化还原NOx可在一定程度上消除氮氧化物的污染。
已知:CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
2NO2(g)+N2(g)![]() 4NO(g) △H=+293kJ·mol-1
4NO(g) △H=+293kJ·mol-1
则反应CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g)的△H=___________kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)的△H=___________kJ·mol-1
(3)800℃时,在刚性反应器中以投料比为1︰1的NO(g)与O2(g)反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,NO(g)完全反应]。

①NO(g)与O2(g)合成的反应速率v=4.2×10-2×p2(NO)×p(O2)(kPa·min-1),t=52min时,测得体系中p(O2)=11.4kPa,则此时的p(NO)=___________kPa, v=___________kPa·min-1(计算结果保留1位小数)。
②若升高反应温度至900℃,则NO(g)与O2(g)完全反应后体系压强p∞(900℃)______(填“大于”等于”或“小于”)22.3kPa,原因是______________________。
③800℃时,反应N2O4(g)![]() 2NO2(g)的平衡常数Kp=___________kPa(Kp为以分压表示的平衡常数,计算结果保留2位小数)。
2NO2(g)的平衡常数Kp=___________kPa(Kp为以分压表示的平衡常数,计算结果保留2位小数)。
(4)对于反应2NO(g)+O2(g)→2NO2(g),科研工作者提出如下反应历程:
第一步:2NO(g)![]() N2O2(g) 快速平衡
N2O2(g) 快速平衡
第二步:N2O2+O2(g)→2NO2(g) 慢反应
下列表述正确的是___________(填标号)。
A.v(第一步的逆反应)>v第二步反应
B.反应的中间产物为N2O2
C.第二步中N2O2与O2的碰撞全部有效
D.第二步反应活化能较低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com