
| 温度 实验次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值(T2-T1)/℃ | ||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1.3376KJ |
| 0.025mol |


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
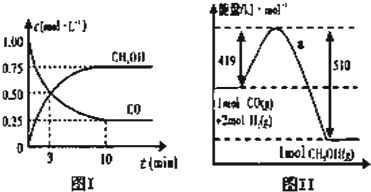
| n(CH3OH) |
| n(CO) |
| 容器 | 甲 | 乙 | 丙 |
| 投料量 | 1mol CO、2mol H2 | 1mol CH3OH | 2mol CH3OH |
| CH3OH的浓度(mol?L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 吸收Q3 kJ |
| 体系压强(Pa) | P1 | P2 | P3 |
| 反应物转化率 | α1 | α2 | α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 改变的条件 | 生成NH3的速率 |
| ① | 升高温度 | |
| ② | 降低温度 | |
| ③ | 增大N2的浓度 | |
| ④ | 使用催化剂 | |
| ⑤ | 压缩体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3、NaHCO3、NaCl、NH4Cl |
| B、Na2CO3、NaHCO3、NH4Cl、NaCl、 |
| C、Na2CO3、NaCl、NH4Cl、NaHCO3 |
| D、Na2CO3、NH4Cl、NaHCO3、NaCl、 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com