
| A、b=2 |
| B、容器中一定没有残余的CO2和水蒸气 |
| C、a≥b |
| D、反应中转移的电子数一定为2NA |
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:

| 温度(℃) | 10 | 20 | 30 | 40 | 50 |
| 溶解度 | 36 | 48 | 60 | 73 | 87 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1,2-二氯丙烷 |
| B、1,1-二氯丙烷 |
| C、1,3-二氯丙烷 |
| D、2,2-二氯丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
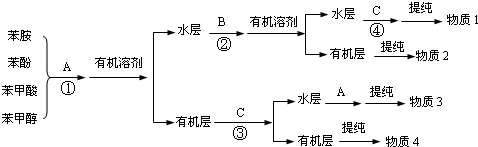
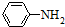 )有弱碱性,可与盐酸等反应生成盐;
)有弱碱性,可与盐酸等反应生成盐;查看答案和解析>>
科目:高中化学 来源: 题型:
| v2o5 |
| △ |
| A、催化剂V2O5不改变该反应的逆反应速率 | ||
| B、增大反应体系的压强,反应速率一定增大 | ||
| C、该反应是放热反应,降低温度将缩短反应达到平衡的时间 | ||
D、在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率v=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、形成原电池后,原电池中的阳离子向正极移动 |
| B、原电池中电子流出的一极是正极,发生氧化反应 |
| C、原电池的两极发生的反应均为氧化还原反应 |
| D、原电池是把电能转化为化学能的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、60g水晶晶体中,含有“Si-O”键的数目为2NA |
| B、14g氮气含有π键数为2NA |
| C、18g冰中含有的氢键数目为2NA |
| D、12g金刚石中含有C-C键的数目为4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com