
| A、60g水晶晶体中,含有“Si-O”键的数目为2NA |
| B、14g氮气含有π键数为2NA |
| C、18g冰中含有的氢键数目为2NA |
| D、12g金刚石中含有C-C键的数目为4NA |
| m |
| M |
| m |
| M |
| m |
| M |
| m |
| M |
| m |
| M |
| 60g |
| 60g/mol |
| m |
| M |
| 14g |
| 28g/mol |
| m |
| M |
| 18g |
| 18g/mol |
| m |
| M |
| 12g |
| 12g/mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、b=2 |
| B、容器中一定没有残余的CO2和水蒸气 |
| C、a≥b |
| D、反应中转移的电子数一定为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 空气 |
| △ |
| HNO3(稀) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 强电解质 | NaCl | H2SO4 | CaCO3 | HNO3 |
| 弱电解质 | HF | 氨水 | HClO | HI |
| 非电解质 | Cl2 | 蔗糖 | C2H5OH | SO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,1.7g NH3含有NA个电子 |
| B、标准状况下,22.4L水中含H2O分子NA个 |
| C、1molNa完全反应生成NaCl时,失去NA个电子 |
| D、常温常压下,22.4LCO2中含有的CO2分子数小于NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
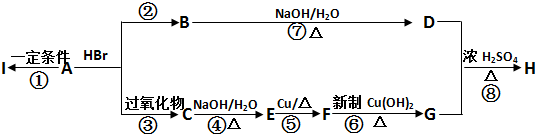
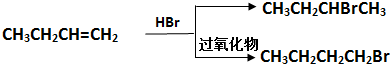
| NaOH/H2O |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
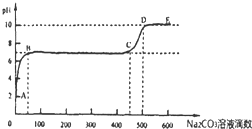
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、AlO2-、NO3-、Cl- |
| B、MnO4-、H+、K+、NO3- |
| C、Ba2+、Na+、HCO3-、OH- |
| D、K+、SO42-、S2-、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com