
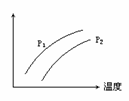
右图表示温度、压强对达平衡的可逆反应:2L(g) 2M(g)+N(g) △H>0的影响(P1<P2 ) 图中y轴表示的意义是 ( )
2M(g)+N(g) △H>0的影响(P1<P2 ) 图中y轴表示的意义是 ( )
A.混合物中L的百分含量
B.混合气体的密度
C.L的转化率
D.混合气体的平均分子量
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为________。
(2)Na的原子结构示意图为________,Na在氧气中完全燃烧所得产物的电子式为________。
(3)MgCl在工业上应用广泛,可由MgO制备。
①MgO的熔点比BaO的熔点________(填“高”或“低”)。
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为__________________________;SiO2的晶体类型为________。
③MgO与炭粉和氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收,则生成的盐为________________(写化学式)。
(4)月壤中含有丰富的3He,从月壤中提炼1 kg 3He,同时可得6000 kg H2和700 kg N2,若以所得H2和N2为原料经一系列反应最多可生产碳酸氢铵________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最处层电子数相同。回答下列问题:
(1)X、Y和Z的元素符号分别为 、 、 。
(2)由上述元素组成的化合物中,既含有共价键又含有离子键的有 、 。
(3)X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是 。
此化合物在酸性条件下与高锰酸钾反应的离子方程式为 ;此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行反应X2(g)+Y2(g)  2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
A.Z为0.2 mol·L-1 B.Y2为0.35 mol·L-1
C.X2为0.3 mol·L-1 D.Z为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知
(1)H2O(g) == H2O(l) ΔH1=-Q1 kJ·mol-1
(2)CH3OH(g) == CH3OH(l) △H2=-Q2 kJ·mol-1
(3)2CH3OH(g) +3O2(g) == 2CO2(g)+4H2O(g) △H3=-Q3 kJ·mol-1
(Q1、Q2、Q3均大于0)若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ) ( )
A.Q1+Q2+Q3 B. 0.5 Q3-Q2+2Q1 C. 0.5 Q3+ Q2-2Q1 D. 0.5(Q1+Q2+Q3)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍。下列说法正确的是( )
A.R的原子半径比Z的大 B.R的氢化物的热稳定性比W的强
C.X与Y形成的化合物只有一种 D.Y的最高价氧化物的水化物的酸性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大。A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4;G+的M层电子全充满。用化学式或化学符号回答下列问题:
(1)G的基态原子的外围电子排布式为_______________________________________,周期表中属于________区。
(2)B与F形成的一种非极性分子的电子式为____________________________;F的一种具有强还原性的氧化物分子的VSEPR模型为________________。
(3)BD2在高温高压下所形成的晶胞如下图所示。该晶体的类型属于________(选填“分子”、“原子”、“离子”或“金属”)晶体。

(4)设C元素的气态氢化物为甲,最高价氧化物的水化物为乙,甲与乙反应的产物为丙。常温下,有以下3种溶液:①pH=11的甲的水溶液 ②pH=3的乙的水溶液 ③pH=3的丙溶液,3种溶液中水电离出的c(H+)之比为________________。
(5)丁、戊分别是E、F两种元素最高价含氧酸的钠盐,丁、戊溶液能发生反应。当丁、戊溶液以物质的量之比为1∶4混合后,溶液中各离子浓度大小顺序为____________________。
(6)A和C形成的某种氯化物CA2Cl可作杀菌剂,其原理为CA2Cl遇水反应生成一种具有强氧化性的含氧酸,写出CA2Cl与水反应的化学方程式:____________________________。
(7)往G的硫酸盐溶液中加入过量氨水,可生成一种配合物X,下列说法正确的是________。
A.X中所含化学键有离子键、极性键和配位键
B.X中G2+给出孤对电子,NH3提供空轨道
C.组成X的元素中第一电离能最大的是氧元素
D.SO 与PO
与PO 互为等电子体,空间构型均为正四面体
互为等电子体,空间构型均为正四面体
查看答案和解析>>
科目:高中化学 来源: 题型:
到目前为止,由化学能转变为热能或电能仍然是人类使用最主要的能源。
(1)化学反应中放出的热能(焓变,ΔH)与反应物和生成物在反应过程中断键和形成新键过程中吸收和放出能量的大小有关。
已知:H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ·mol-1,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为________。
(2)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=-890.3 kJ·mol-1
②C(s,石墨)+O2(g)===CO2(g)
ΔH=-393.5 kJ·mol- 1
1
③2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1
标准状况下22.4 L氢气和甲烷的混合气体在足量的氧气中充分燃烧反应放出588.05 kJ的热量,原混合气体中氢气的质量是________。根据以上三个热化学方程式,计算C(s,石墨)+2H2(g)===CH4(g)的反应热ΔH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物甲可氧化生成羧酸,也可还原生成醇。由甲生成的羧酸和醇在一定条件下反应可以生成化合物乙,其分子式为C2H4O2。下列叙述不正确的是( )
A.甲分子中碳的质量分数为40%
B.甲在常温、常压下为无色液体
C.乙比甲的沸点高
D.乙和甲的实验式相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com