
在密闭容器中进行反应X2(g)+Y2(g)  2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
A.Z为0.2 mol·L-1 B.Y2为0.35 mol·L-1
C.X2为0.3 mol·L-1 D.Z为0.4 mol·L-1
科目:高中化学 来源: 题型:
下列说法正确的是
A.共价化合物中可能含有离子键
B.区别离子化合物和共价化合物的方法是看其水溶液是否能够导电
C.离子化合物中只含有离子键
D.离子化合物熔融状态能电离出自由移动的离子,而共价化合物不能
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知
| W | X | |
| Y | Z |
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.X元素形成的单核阴离子还原性强于Y
D.Z元素单质在化学反应中只表现氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组为了检验硫酸亚铁铵晶体中含有NH 、Fe2+、SO
、Fe2+、SO 和H2O,设计了如下实验步骤:①取少量晶体放在试管内,用酒精灯加热,试管口有液体产生说明晶体中含有水;
和H2O,设计了如下实验步骤:①取少量晶体放在试管内,用酒精灯加热,试管口有液体产生说明晶体中含有水;
②将加热后剩余的晶体溶解于水,加入盐酸酸化的氯化钡溶液,有白色沉淀生成,说明晶体中含有SO ;
;
③滤去白色沉淀,向滤液中加入过量的浓氢氧化钠溶液,加热,有能使红色石蕊试纸变蓝的气体产生,说明晶体中含有NH ;
;
④向步骤③的剩余液体中加入KSCN溶液,无明显变化,再加入少量氯水,溶液变血红色,说明晶体中含有亚铁离子。其中不能达到实验目的的是( )
A.①③④ B.①④
C.③④ D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应:A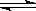 B + C 在室温下不能自发进行,在高温下能自发进行,对该反应过程△H、△S的判断正确的是( )
B + C 在室温下不能自发进行,在高温下能自发进行,对该反应过程△H、△S的判断正确的是( )
A.△H<0、△S<0 B.△H>0、△S<0
C.△H<0、△S>0 D.△H>0、△S>0
查看答案和解析>>
科目:高中化学 来源: 题型:
下列不能说明氯元素的非金属性比硫元素强的事实是( )
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S ⑤Cl原子最外层有7个电子,S原子最外层有6个电子 ⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS。
A.②⑤ B.①② C.①②④ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
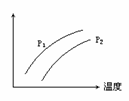
右图表示温度、压强对达平衡的可逆反应:2L(g) 2M(g)+N(g) △H>0的影响(P1<P2 ) 图中y轴表示的意义是 ( )
2M(g)+N(g) △H>0的影响(P1<P2 ) 图中y轴表示的意义是 ( )
A.混合物中L的百分含量
B.混合气体的密度
C.L的转化率
D.混合气体的平均分子量
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于金属及金属键的说法正确的是
A.金属键具有方向性与饱和性
B.金属键是金属阳离子与自由电子间的相互作用
C.金属导电是因为在外加电场作用下产生自由电子
D.金属具有光泽是因为金属阳离子吸收并放出可见光
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.鸡蛋壳浸泡在盐酸中产生气泡:CO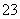 +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
B.四氧化三铁固体溶解在稀硝酸中: Fe3O4+8H+===2Fe3++Fe2++4H2O
C.将氨气通入硫酸溶液中: NH3+H+===NH
D.向碳酸氢铵溶液中加入足量的NaOH溶液: NH +OH-===NH3·H2O
+OH-===NH3·H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com