
【题目】X是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质X的晶体类型为___________,其中X原子的配位数为___________。
(2)元素Y基态原子的核外电子排布式为_____________,同周期元素中,第一电离能最大的是___________(写元素符号)。
(3)X与Y形成的一种化合物的立方晶胞如图所示。
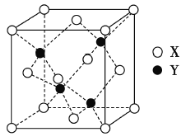
①该化合物的化学式为____________________,已知晶胞参数a=0.542nm,此晶体的密度为____________ g·cm-3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是________。
【答案】金属晶体 12 1s22s22p63s23p5 Ar CuCl ![]() Cu2+可与氨形成易溶于水的配位化合物(或配离子)
Cu2+可与氨形成易溶于水的配位化合物(或配离子)
【解析】
X是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子,原子核外电子数=2+8+18+1=29,则X为Cu;元素Y的负一价离子的最外层电子数与次外层的相同,原子只能有3个电子层,最外层电子数为7,则Y为Cl元素。
(1)铜是金属,属于金属晶体,晶体中金属阳离子与电子之间通过金属键结合在一起;铜晶体中原子为面心立方最密堆积;
(2)Y是Cl元素,Cl是17号元素,结合能量最低原理书写原子核外电子排布式;同一周期元素中稀有气体的第一电离能最大;
(3)①均摊法计算晶胞中Cu、Cl原子数目,确定化学式,计算晶胞中原子总质量,晶体密度![]() 计算;②根据物质容易形成配位化合物分析。
计算;②根据物质容易形成配位化合物分析。
根据上述推断可知X是Cu元素,Y是Cl元素。
(1)铜属于金属,金属阳离子与电子之间通过金属键结合在一起,晶体类型为金属晶体,铜晶体是面心立方最密堆积,铜原子的配位数是12;
(2)Cl元素是17号元素,根据构造原理可知基态Cl原子核外电子排布式为1s22s22p63s23p5,Cl位于第三周期,同一周期的元素的第一电离能随原子序数的增大而增大,所以稀有气体原子为稳定结构,其同周期元素中第一电离能最大的是Ar;
(3)①晶胞中含有铜原子个数为:8×![]() +6×
+6×![]() =4,Cl原子个数为4,Cu、Cl原子数目之比为1:1,则化学式为:CuCl,晶胞质量m(晶胞)=4×
=4,Cl原子个数为4,Cu、Cl原子数目之比为1:1,则化学式为:CuCl,晶胞质量m(晶胞)=4×![]() g,则晶体的密度ρ=
g,则晶体的密度ρ=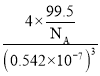 g/cm3=
g/cm3=![]() g/cm3;②Cu2+容易与氨水中的NH3形成络离子,因此容易溶解在氨水中。
g/cm3;②Cu2+容易与氨水中的NH3形成络离子,因此容易溶解在氨水中。


科目:高中化学 来源: 题型:
【题目】胡妥油(D)是香料的原料,它可由 A 合成得到: 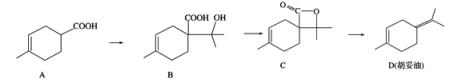
下列说法正确的是( )
A.有机物 B 的分子式为 C11H19O3
B.1mol B 与足量的 Na 反应可产生 11.2LH 2 (已换算成标准状况)
C.有机物 C 的所有同分异构体中可能有芳香族化合物存在
D.一定条件下,A分别可以发生加成、取代、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计如下实验装置(图中夹持装置省略)测定制备的CaCO3粉末的纯度(样品中杂质不与酸反应,反应前装置中的CO2已全部排出)。下列说法错误的是( )
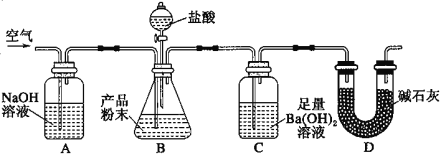
A.缓缓通入空气的作用是将反应结束后装置中残留的CO2全部鼓入到C装置中被吸收
B.A装置和D装置都是为了防止空气中的CO2气体进入C 装置而产生误差
C.若CaCO3样品的质量为x,从C 中取出的沉淀洗净干燥后的质量为y,则CaCO3的纯度为![]()
D.为了防止B 中盐酸挥发产生干扰,必须在B、C装置中间加一个装有饱和碳酸氢钠溶液的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硫元素及其化合物的说法正确的是
A.硫黄矿制备硫酸经历两步:S![]() SO3
SO3![]() H2SO4
H2SO4
B.酸雨与土壤中的金属氧化物反应后,硫元素以单质的形式进入土壤中
C.在燃煤中加入石灰石可减少SO2排放,发生的反应为2CaCO3+2SO2+O2![]() 2CO2+2CaSO4
2CO2+2CaSO4
D.向溶液中加入BaCl2溶液后滴加硝酸,若产生不溶于硝酸的白色沉淀,则溶液必含SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定条件下,向密闭容器中充入一定量的气体X,发生反应3X(g)![]() Y(g)+xZ(g),一段时间后反应达到平衡。12min时,将容器体积压缩至原来的一半,一段时间后反应再次达到平衡。反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是( )
Y(g)+xZ(g),一段时间后反应达到平衡。12min时,将容器体积压缩至原来的一半,一段时间后反应再次达到平衡。反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是( )
反应时间(min) | 0 | 5 | 12 | 17 | 20 |
X的浓度(mol·L-1) | 1.0 | 0.4 | 0.4 | 0.7 | 0.7 |
A.x=1
B.5min时该反应处于化学平衡状态
C.从反应开始到18min时,X的转化率为30%
D.05min内,该反应的平均速率为v(X)=0.12mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图为测定中和热的实验装置图。请回答下列问题:
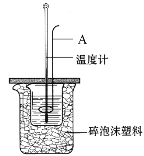
①仪器A的名称为___;
②如果用0.50mol·L-1的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”的数值将___(填“偏大”、“偏小”或“不变”)
(2)近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

①根据如图,请写出系统(II)中制氢的热化学方程式___;
②系统(I)和系统(II)相比,制得等量H2所需能量较少的是__(填“I”或“II”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶澄清的溶液,只可能含有 NH4+、Na+、Mg2+、Ba2+、Fe3+、Clˉ、Brˉ、Iˉ、CO32ˉ、SO42—中的几种,且浓度均为 0.1mol L—1。进行以下实验:
①取少量溶液,滴加盐酸至溶液呈酸性,无明显现象。
②取少量溶液,滴加少许新制氯水,再加淀粉溶液,溶液变蓝
③取少量溶液,向其中逐滴加入 NaOH 溶液至碱性,过程中均无沉淀产生。将此溶液分为两等份,第一份加热,有气体放出;第二份溶液中加入Na2CO3 溶液,有白色沉淀生成。下列结论不正确的是
A.肯定含有的阳离子是 NH4+、Ba2+
B.肯定含有的阴离子是Iˉ、Clˉ、Brˉ
C.肯定不含有的离子是 Fe3+、CO32ˉ、SO42ˉ
D.不能确定是否含有的离子是 Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①CH3COONa溶液呈碱性,原因是____________________(用化学用语表达)。
②在CH3COONa溶液中,各个离子浓度大小关系为_________________________
③写出碳酸钠溶液中电荷守恒关系式_________________________________________
(2)已知:C(s)+H2O(g)![]() CO(g)+H2(g) △H=+131.3kJ/mol。
CO(g)+H2(g) △H=+131.3kJ/mol。
①该反应是________(填“吸热”或“放热”)反应。
②它若反应消耗24gC(s),则反应吸收的热量为___________。
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol通入容积为2.0L的恒容密闭容器中,发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到下表中数据:
CO2(g)+H2(g),得到下表中数据:
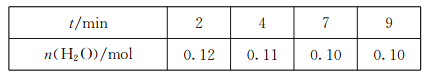
①2min内,v(CO)=________。
②该温度下,此反应的平衡常数的值是________。
③其他条件不变,再充入0.1molCO和0.molH2O(g),达到平衡时CO的体积分数_____(填“增大”“减小”或“不变”)。
(4)下图为直流电源电解CuSO4溶液的装置,C1和C2都为石墨电极。请回答下列问题:
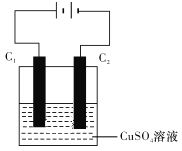
①C1作______(填“阳极”或“阴极”)。
②C2电极的电极反应式为___________。
③惰性电极电解CuSO4溶液的化学方程式是_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。

已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为紫红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
(1)常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为___________。
(2)E与G的稀溶液反应的离子方程式为_________。
(3)在25 ℃和101 kPa的条件下,将VL的B气体溶于100 mL水中,得到密度为ρg·mL-1的溶液M,则M溶液的物质的量浓度为________ mol·L-1。(已知25 ℃、101 kPa条件下气体摩尔体积为24.5 L·mol-1,不必化简)
(4)分别蘸取B的浓溶液和G的浓溶液的玻璃棒,接近后的现象是_________。
(5)B和C反应的化学方程式为__________。
(6)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com