
【题目】—定条件下,向密闭容器中充入一定量的气体X,发生反应3X(g)![]() Y(g)+xZ(g),一段时间后反应达到平衡。12min时,将容器体积压缩至原来的一半,一段时间后反应再次达到平衡。反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是( )
Y(g)+xZ(g),一段时间后反应达到平衡。12min时,将容器体积压缩至原来的一半,一段时间后反应再次达到平衡。反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是( )
反应时间(min) | 0 | 5 | 12 | 17 | 20 |
X的浓度(mol·L-1) | 1.0 | 0.4 | 0.4 | 0.7 | 0.7 |
A.x=1
B.5min时该反应处于化学平衡状态
C.从反应开始到18min时,X的转化率为30%
D.05min内,该反应的平均速率为v(X)=0.12mol·L-1·min-1
【答案】C
【解析】
12min时,将容器体积压缩至原来的一半,若平衡不移动,X的浓度应为0.8mol/L;达到新的平衡时,X的浓度为0.7mol/L,说明X在减少,平衡正向移动。压缩体积,增大压强,平衡向气体体积减小的方向移动,则3>1+x,则x=1。
A.c(X)=0.4mol/L时,将容器体积压缩至原来的一半,此时c(X)=0.8mol/L,平衡时c(X)=0.7mol/L,表明平衡正向移动,3>1+x,所以x=1,正确,A不选;
B.根据数据,5min和12min的X的浓度不变,说明该反应处于化学平衡状态,正确,B不选;
C.设原容器体积为1L,则n(X)起=1.0mol,平衡时,容器体积为0.5L,n(X)平=0.5L×0.7mol/L=0.35mol,从反应开始到18min时,X的转化率为![]() =65%,不正确,C选;
=65%,不正确,C选;
D.05min内,该反应的平均速率为v(X)=![]() =0.12mol·L-1·min-1,正确,D不选;
=0.12mol·L-1·min-1,正确,D不选;
故选C。


科目:高中化学 来源: 题型:
【题目】利用下列装置可以制备无水氯化铁。下列有关说法正确的是( )
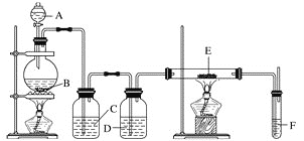
A. 烧瓶B中制备氯气的反应物为MnO2和稀盐酸
B. 装置C、D中分别盛有浓硫酸、饱和食盐水
C. 装置E和装置F之间需要增加一个干燥装置,才能制得无水氯化铁
D. 装置F的目的是检验有无氯气逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物对香豆酸(![]() )主要用于配置香辛樱桃、杏、蜂蜜等香料.
)主要用于配置香辛樱桃、杏、蜂蜜等香料.
(1)下列关于对香豆酸的说法不正确的是___.
a.能与NaOH溶液反应 b.能发生加成、取代、银镜反应
c.加金属钠,有氢气生成 d.加FeCl3溶液,溶液显紫色
(2)对香豆酸的某种同分异构体丁,可用于除草剂苯嗪草酮的中间体,其可通过下图转化关系制得.
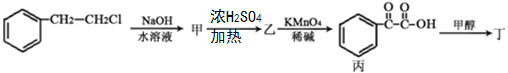
①甲→乙的反应类型_______;乙→丙的反应类型_______;
②甲分子所含官能团是_____(填名称);乙的结构简式:______________;
③丙→丁的反应化学方程式:___________________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类生活、工业生产往往产生大量含碳、氮、硫的废弃气体,合理再利用或转化上述气体,变废为宝成为人们共同关注的课题。
I.某化学课外小组查阅资料后得知:2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
请回答下列问题:
(1)反应2NO(g)+O2(g)![]() 2NO2(g)的H=_______(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的H=_______(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_______。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_______。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1______E2(填“>”、“<”或“=”)。
2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1______E2(填“>”、“<”或“=”)。
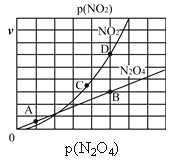
(3)反应N2O4(g)![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是________。
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是________。
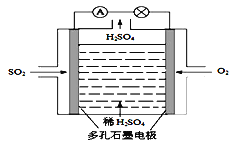
II.某学习小组以SO2为原料,采用电化学方法制取硫酸。
(4)原电池原理:该小组设计的原理示意图如图,写出该电池负极的电极反应式_____。
(5)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如图,写出开始电解时阳极的电极反应式_________。

(6)已知25℃时由Na2SO3和NaHSO3形成的混合溶液恰好呈中性,则该混合溶液中各离子浓度的大小顺序为______(已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述与图象相对应的是
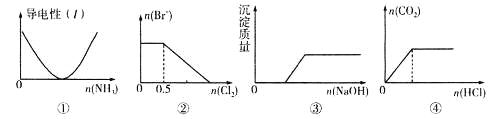
A.图①表示向乙酸溶液中通入氨气至过量的过程中溶液导电性的变化
B.图②表示向1 L l mol·L-1FeBr2溶液中通入Cl2时Br-物质的量的变化
C.图③表示向Ca(HCO3)2溶液中滴加NaOH溶液时沉淀质量的变化
D.图④表示向一定浓度的Na2CO3溶液中滴加盐酸,生成CO2的物质的量与滴加盐酸物质的量的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质X的晶体类型为___________,其中X原子的配位数为___________。
(2)元素Y基态原子的核外电子排布式为_____________,同周期元素中,第一电离能最大的是___________(写元素符号)。
(3)X与Y形成的一种化合物的立方晶胞如图所示。
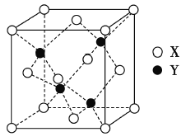
①该化合物的化学式为____________________,已知晶胞参数a=0.542nm,此晶体的密度为____________ g·cm-3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有Al2(SO4)3和Na2SO4的混合溶液V L,将它均分成两份。一份滴加氨水,使Al3+完全沉淀;另一份滴加BaCl2溶液,使SO![]() 完全沉淀。反应中消耗a mol NH3·H2O、b mol BaCl2。据此得知原混合溶液中的c(Na+)(mol·L-1)为( )
完全沉淀。反应中消耗a mol NH3·H2O、b mol BaCl2。据此得知原混合溶液中的c(Na+)(mol·L-1)为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰酸铵(NH4CNO)受热转化成尿素[CO(NH2)2]的反应在有机化学史上具有里程碑事件,打破了“有机物不能有无机物制得”的观念。在后来的实验中发现,尿素可以由氨气和二氧化碳反应生成,尿素也可以在一定条件下失去氨而缩合,如两分子尿素失去一分子氨,则形成二聚物--缩二脲。下列关于尿素及其缩合产物的说法中错误的是( )
A.与尿素分子式相同的物质有不止一种
B.可以推测,尿素也可以缩合形成聚合产物
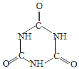
C.缩二脲中有肽键,因此缩二脲是一种二肽
D.若尿素生成三聚产物--缩三脲,则生成一分子缩三脲的同时,失去两分子氨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃与氢气发生反应后能生成(CH3)2CHCH2CH3,则该烃不可能是( )
A.2-甲基-2-丁烯B.2-甲基-1-丁烯
C.3-甲基-1-丁炔D.2,3-二甲基-1-丁炔
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com