
【题目】LiH是制备有机合成的重要还原剂LiAlH4的反应物,氢化锂遇水蒸气剧烈反应。某小组设计如图装置制备LiH。
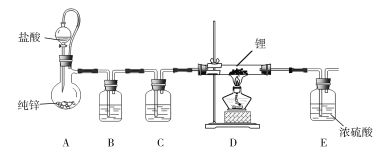
下列说法正确的是
A. 装置B、C依次盛装浓硫酸、饱和食盐水B. 装置A中加入硫酸铜越多,反应速率越大
C. 装置E用于吸收尾气,避免污染环境D. 实验中,先通入H2,后点燃酒精灯
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是
CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是
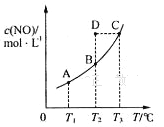
A.该反应的△H>0
B.在T2时,若 反 应 体 系 处于 状 态D ,则 此 时v正>v逆
C.若状态B、C、D的压强分别为PB、PC 、PD ,则PC=PD>PB
D.若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,密闭容器中充入一定物质的量的NO2 和SO2 ,发生如下反应: NO2+ SO2![]() NO + SO3 ,达到平衡时,下列叙述正确的是
NO + SO3 ,达到平衡时,下列叙述正确的是
A、 SO2 、NO2、NO、SO3 的物质的量一定相等
B、 NO2和 SO2 的物质的量一定相等
C、平衡体系中反应物的总物质的量一定等于生成物的总物质的量
D、NO 和 SO3 的物质的量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置![]() 夹持装置略去
夹持装置略去![]() 验证CO能还原CuO并制备一定量的铜,下列说法错误的是
验证CO能还原CuO并制备一定量的铜,下列说法错误的是

A.![]() 中盛装的试剂可以是无水氯化钙
中盛装的试剂可以是无水氯化钙
B.实验中会造成环境污染
C.停止加热时首先应熄灭![]() 处酒精灯
处酒精灯
D.若![]() 中试剂减轻
中试剂减轻![]() ,则
,则![]() 中试剂会减轻
中试剂会减轻![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为周期表的一小部分,A、B、C、D、E 的位置关系如图所示。其中 B 元素最高化合价是最低化合价绝对值的 3 倍,它的最高价氧化物中含氧 60%。下列说法正确的( )
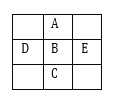
A.D、B、E 三种元素的非金属性逐渐减小
B.B 元素最高价氧化物对应的水化物是强酸
C.A 元素是空气中含量最多的元素
D.气态氢化物的稳定性顺序: D > B > E
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中,某化学反应2A![]() B+D在四种不同条件下进行,A、B、D都为气体,且B、D起始浓度为0,反应物A的物质的量(mol)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,A、B、D都为气体,且B、D起始浓度为0,反应物A的物质的量(mol)随反应时间(min)的变化情况如下表:

根据上述数据,回答以下问题:
(1)实验1中,10至30分钟时间内A的平均反应速率为________mol·L-1·min-1,达平衡时B物质的浓度为________,A的转化率为________。
(2)实验2中,隐含的反应条件可能是________。
(3)实验3中,A的起始的物质的量________(填“>”“<”或“=”)1.0 mol,实验3和实验1的起始速率v3________(填“>”“<”或“=”)v1,由实验1和实验5可确定上述反应为________(填“放热”或“吸热”) 反应,实验4中,该反应温度下其平衡常数为________。
(4)若开始时在实验2的密闭容器中充入1.0molB,1.0molD,达平衡时A物质的浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验制备Ca(NO2)2,实验装置如图所示(夹持装置已略去)。已知:2NO+CaO2==Ca(NO2)2;2NO2+CaO2==Ca(NO3)2。下列说法不正确的是

A. 通入N2是为了排尽装置中的空气
B. 装置B、D中的试剂可分别为水和浓硫酸
C. 将铜片换成木炭也可以制备纯净的亚硝酸钙
D. 借助装置A及氢氧化钠溶液和稀硫酸可以分离CO2和CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应PbS+O2 ![]() Pb+SO2。
Pb+SO2。
(1)请将上述反应用单线桥法标出电子转移的方向和数目:________________________________________
(2)上述反应的氧化剂是 _________________,还原剂是_______________,氧化产物是________________,还原产物是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,重水中存在电离平衡D2O![]() D++OD-,D2O的离子积常数为1.0×10﹣12,若pD=-lg c(D+),该温度下有关分析不正确的是( )
D++OD-,D2O的离子积常数为1.0×10﹣12,若pD=-lg c(D+),该温度下有关分析不正确的是( )
A.0.1 mol NaOD溶于重水制成1 L溶液,pD=13
B.将pD=4的DCl的重水溶液稀释100倍,所得溶液pD不等于6
C.向30 mL0.5 mol/L NaOD的重水溶液中加入20 mL 0.5 mol/L DCl的重水溶液,所得溶液pD = 11
D.pD = 10的NaOD的重水溶液中,由重水电离出的c(OD-)为1×10﹣10mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com