
【题目】在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是
CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是
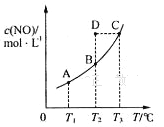
A.该反应的△H>0
B.在T2时,若 反 应 体 系 处于 状 态D ,则 此 时v正>v逆
C.若状态B、C、D的压强分别为PB、PC 、PD ,则PC=PD>PB
D.若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是
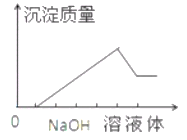
A. Mg2+、Al3+、Fe3+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mol)随时间t(min)的变化如图所示。已知达平衡后,降低温度,A的体积分数将减小。
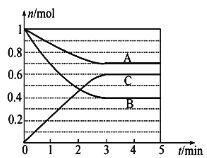
(1)该反应的化学方程式为__________。
(2)该反应的反应速率v随时间t的关系如图所示:
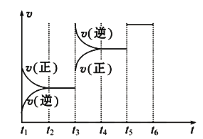
①根据上图判断,在t3时刻改变的外界条件是____________。
②A的转化率最大的一段时间是________。
③各阶段的平衡常数如下表所示:
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
K1、K2、K3之间的大小关系为________(用“>”、“<”或“=”连接)。
Ⅱ.在密闭容器中充入一定量的H2S,发生反应2H2S(g) ![]() 2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
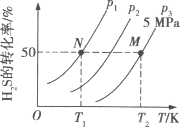
(1)△H___ (填“>”“<”或“ = ”)0。
(2)图中压强(p1、p2、p3)的大小顺序为____。
(3)图中M点的平衡常数Kp =____MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(固)+nB(气)![]() pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
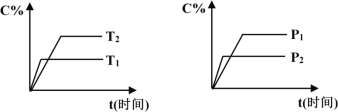
A. 达到平衡后,使用催化剂,C%将增大
B. 达到平衡后,若升高温度、化学平衡向逆反应方向移动
C. 方程式中n>p+q
D. 达到平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是( )
A.W与X元素的单质在常温下不反应
B.X、Y、Z、W的原子半径依次减小
C.W的气态氢化物的沸点一定低于Z的气态氢化物的沸点
D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某浓度的氨水中存在下列平衡:NH3H2O![]() NH4++OH-,若想增大NH4+的浓度,而不增加OH-的浓度,应采取的措施是__。(填序号)
NH4++OH-,若想增大NH4+的浓度,而不增加OH-的浓度,应采取的措施是__。(填序号)
①适当升高温度②加入NH4Cl固体③通入NH3④通入少量HCl气体
(2)常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,产生等量的氢气时,所需要的时间:醋酸_____盐酸(填“>”、“=”或“<”)。
(3)已知电离平衡常数,H2SO3:K1 = 1.54×10-2,K2 = 1.02×10-7;H2CO3:K1 = 4.3×10-7,K2 = 5.6×10-11; CH3COOH:Ka=1.8×105。
① HSO3-的电离平衡常数表达式为:______。
② H2SO3溶液与NaHCO3溶液反应的主要离子方程式为_________。
③在25℃的条件下,向0.1mol·L1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO)=5∶9,此时溶液pH=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
铁及其氧化物是日常生活生产中应用广泛的材料。请回答下列问题:
(l)基态铁原子的价电子轨道表达式为__________。
(2)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+_______Fe2+(填“大于”或“小于”),原因是________________。
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,NH4+的结构式为______(标出配位键),空间构型为_________,其中氮原子的杂化方式为_______;与ClO4-互为等电子体的分子或离子有__________(任写两种)。
(4)金属铁晶体原子采用________堆积.铁晶体的空间利用率为______(用含π的式子表示)。
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该权化物中Fe2+、Fe3+、O2-的个数比为_______(填最简整数比);己知该晶体的密度为dg/cm3,阿伏加德罗常数的值为NA,则品胞参数a 为_______nm(用含d 和NA的代数式表示)。
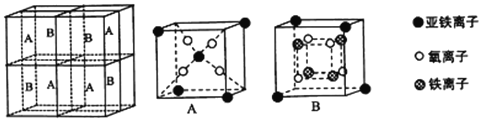
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiH是制备有机合成的重要还原剂LiAlH4的反应物,氢化锂遇水蒸气剧烈反应。某小组设计如图装置制备LiH。
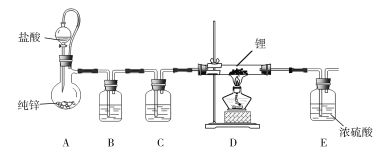
下列说法正确的是
A. 装置B、C依次盛装浓硫酸、饱和食盐水B. 装置A中加入硫酸铜越多,反应速率越大
C. 装置E用于吸收尾气,避免污染环境D. 实验中,先通入H2,后点燃酒精灯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com