
ЁОЬтФПЁПГЃЮТЯТЃЌгУpHДЋИаЦїНјааЪ§зжЛЏЪЕбщЃЌЗжБ№ЯђСНИіЪЂ50mL 0.100mol/L бЮЫсЕФЩеБжадШЫйЕЮМг50mL ШЅРызгЫЎЁЂ50mL 0.100mol/L ДзЫсяЇШмвКЃЌЕЮМгЙ§ГЬНјааДХСІНСАшЃЌВтЕУШмвКpHЫцЪБМфБфЛЏШчЯТЭМЫљЪОЁЃвбжЊГЃЮТЯТДзЫсяЇШмвКpH=7ЃЌЯТСаЫЕЗЈДэЮѓЕФЪЧ
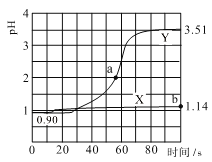
A.ЧњЯпXБэЪОбЮЫсжаМгЫЎЯЁЪЭЕФpHБфЛЏ
B.ЧњЯпYЕФpHБфЛЏжївЊЪЧвђЮЊCH3COO-гыH+НсКЯГЩСЫШѕЕчНтжЪ
C.aЕуЖдгІЕФШмвКжаc(Cl-)ЃЋc(CH3COO-)ЃЋc(CH3COOH)-c(NH4+)=0.01mol/L
D.bЕуЖдгІЕФШмвКжаЫЎЕчРыЕФc(H+)=10-12.86mol/L
ЁОД№АИЁПC
ЁОНтЮіЁП
МгЫЎЯЁЪЭЖдpHБфЛЏгАЯьаЁЃЌМгШыДзЫсяЇЗЂЩњCH3COO-+H+![]() CH3COOHЃЌЩњГЩCH3COOHШѕЕчНтжЪЪЙc(H+)МБОчМѕаЁЃЌpHБфЛЏДѓЃЌЙЪЧњЯпXБэЪОбЮЫсжаМгЫЎЯЁЪЭЃЌЧњЯпYБэЪОбЮЫсжаМгШыДзЫсяЇЁЃ
CH3COOHЃЌЩњГЩCH3COOHШѕЕчНтжЪЪЙc(H+)МБОчМѕаЁЃЌpHБфЛЏДѓЃЌЙЪЧњЯпXБэЪОбЮЫсжаМгЫЎЯЁЪЭЃЌЧњЯпYБэЪОбЮЫсжаМгШыДзЫсяЇЁЃ
A.ЧњЯпXБфЛЏВЛДѓЃЌБэЪОбЮЫсжаМгЫЎЯЁЪЭЕФpHБфЛЏЃЌAЯюе§ШЗЃЛ
B.МгЫЎЯЁЪЭЖдpHБфЛЏгАЯьаЁЃЌЧњЯпYЗЂЩњCH3COO-+H+![]() CH3COOHЩњГЩCH3COOHШѕЕчНтжЪВХЪЧдьГЩpHБфЛЏДѓЕФдвђЃЌBЯюе§ШЗЃЛ
CH3COOHЩњГЩCH3COOHШѕЕчНтжЪВХЪЧдьГЩpHБфЛЏДѓЕФдвђЃЌBЯюе§ШЗЃЛ
C.ШмвКжаРызггаЃК Cl-ЁЂCH3COO-ЁЂOH-ЁЂH+ЁЂ NH4+ЃЌгЩЕчКЩЪиКуЕУЃКc(Cl-)+c(CH3COO-)+c(OH-)=c(NH4+) +c(H+)ЃЌaЕуЖдгІЕФШмвКжаc(H+)=0.01mol/LДјШыЕШЪНЕУЃКc(Cl-)+c(CH3COO-)+c(OH-)=c(NH4+) +0.01mol/LЃЌБфаЮЕУЃКc(Cl-)+c(CH3COO-)+c(OH-)-c(NH4+)=0.01mol/LЃЌCЯюДэЮѓЃЛ
D.bЕуЖдгІЕФШмвКжаpH=1.14ЃЌШмвКжаc(H+)=10-1.14mol/LЃЌc(OH-)=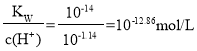 ЃЌЫЎЕчРыВњЩњЕФc(H+)=c(OH-)=10-12.86mol/LЃЌDЯюе§ШЗЃЛ
ЃЌЫЎЕчРыВњЩњЕФc(H+)=c(OH-)=10-12.86mol/LЃЌDЯюе§ШЗЃЛ
Д№АИбЁCЁЃ


 ЗЂЩЂЫМЮЌаТПЮЬУЯЕСаД№АИ
ЗЂЩЂЫМЮЌаТПЮЬУЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПИјЖЈЬѕМўЯТЃЌЯТСабЁЯюжаЫљЪОЕФЮяжЪМфзЊЛЏОљФмвЛВНЪЕЯжЕФЪЧЃЈ ЃЉ
A. ДжЙш![]() SiCl4
SiCl4![]() Si
Si
B. Mg(OH)2![]() MgCl2(aq)
MgCl2(aq)![]() Mg
Mg
C. Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() ЮоЫЎFeCl3
ЮоЫЎFeCl3
D. AgNO3(aq)![]() [Ag(NH3)2]OH(aq)
[Ag(NH3)2]OH(aq)![]() Ag
Ag
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПВнЫс![]() ЪЧвЛжжживЊЕФЛЏЙЄдСЯЁЃФГбЇЯАаЁзщЮЊЬНОПВнЫсЕФаджЪЃЌВщдФСЫгаЙизЪСЯЃЌВнЫсЕФВПЗжаджЪШчЯТБэЃК
ЪЧвЛжжживЊЕФЛЏЙЄдСЯЁЃФГбЇЯАаЁзщЮЊЬНОПВнЫсЕФаджЪЃЌВщдФСЫгаЙизЪСЯЃЌВнЫсЕФВПЗжаджЪШчЯТБэЃК
ЮяжЪ | аджЪ |
|
|
ЪЕбщЂёЃКИљОнЭМЬсЙЉЕФвЧЦїКЭЪдМСЃЌЩшМЦЪЕбщжЄУїВнЫсЕФЪмШШЗжНтВњЮяжаКЌга![]() КЭ
КЭ![]() ВПЗжМаГжвЧЦїКЭМгШШзАжУЪЁТд
ВПЗжМаГжвЧЦїКЭМгШШзАжУЪЁТд![]()
ЃЈ1ЃЉвЧЦїaЕФУћГЦЪЧ_____________ЁЃ
ЃЈ2ЃЉИїзАжУЕФе§ШЗСЌНгЫГађЮЊ![]() зАжУПЩжиИДЪЙгУ
зАжУПЩжиИДЪЙгУ![]() ________
________![]() ________
________![]() ________
________![]() ________
________![]() ЮВЦјДІРэЁЃ________________
ЮВЦјДІРэЁЃ________________
ЃЈ3ЃЉгУЭМжазАжУCЕФзїгУЪЧ____________________________ЁЃ
ЃЈ4ЃЉСЌНгКУзАжУНјааЕФЪЕбщЪБЃЌвЊЯШМгШШ________![]() ЬюЁАAЁБЁАBЁБЁАCЁБЁАDЁБЁАEЁБЛђЁАFЁБ
ЬюЁАAЁБЁАBЁБЁАCЁБЁАDЁБЁАEЁБЛђЁАFЁБ![]() зАжУЃЌФмжЄУїЗжНтВњЮяжагаCOЕФЪЕбщвРОнЪЧ___________________ЁЃ
зАжУЃЌФмжЄУїЗжНтВњЮяжагаCOЕФЪЕбщвРОнЪЧ___________________ЁЃ
ЃЈ5ЃЉФГЭЌбЇВщдФзЪСЯЗЂЯжЃЌгУТШЛЏюй![]() СзютЫсШмвКПЩМьбщвЛбѕЛЏЬМЁЃвЛбѕЛЏЬМгыТШЛЏюйШмвКЗДгІЃЌЩњГЩСЫКкЩЋЕФН№Ъєюй
СзютЫсШмвКПЩМьбщвЛбѕЛЏЬМЁЃвЛбѕЛЏЬМгыТШЛЏюйШмвКЗДгІЃЌЩњГЩСЫКкЩЋЕФН№Ъєюй![]() ЙЬЬхЃЌЗДгІЕФЛЏбЇЗНГЬЪНЪЧ___________________________ЁЃ
ЙЬЬхЃЌЗДгІЕФЛЏбЇЗНГЬЪНЪЧ___________________________ЁЃ
ЪЕбщ ЂђЃКВнЫсгыМзДМдкХЈСђЫсДцдкЯТѕЅЛЏЩњГЩВнЫсЖўМзѕЅЁЃЗДгІЮЊ![]()
![]()
![]() ЁЃдкзАгаНСАшЦїЁЂЗжЫЎЦїЕФЗДгІЦПжаЃЌМгШыВнЫс
ЁЃдкзАгаНСАшЦїЁЂЗжЫЎЦїЕФЗДгІЦПжаЃЌМгШыВнЫс![]() ЃЌЮоЫЎМзДМ
ЃЌЮоЫЎМзДМ![]() ЃЌБН
ЃЌБН![]() ЃЌХЈСђЫс
ЃЌХЈСђЫс![]() ЃЌНСАшЯТМгШШЛиСїЙВЗаЭбЫЎ20аЁЪБЃЌКѓзЊвЦЕНЩеБжаРфШДЃЌАДШчЭМЫљЪОСїГЬЬсДПЁЃ
ЃЌНСАшЯТМгШШЛиСїЙВЗаЭбЫЎ20аЁЪБЃЌКѓзЊвЦЕНЩеБжаРфШДЃЌАДШчЭМЫљЪОСїГЬЬсДПЁЃ
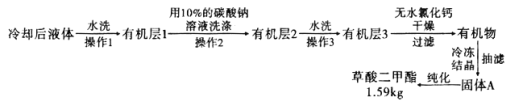
ЃЈ6ЃЉ![]() ЬсДПЙ§ГЬжагУ
ЬсДПЙ§ГЬжагУ![]() ЕФЬМЫсФЦШмвКЯДЕгЕФзїгУЪЧ__________________________ЁЃ
ЕФЬМЫсФЦШмвКЯДЕгЕФзїгУЪЧ__________________________ЁЃ
![]() СїГЬжаДПЛЏЕФЗНЗЈЮЊ________________ЁЃ
СїГЬжаДПЛЏЕФЗНЗЈЮЊ________________ЁЃ
![]() ВњТЪЮЊ____________
ВњТЪЮЊ____________![]() ОЋШЗЕН
ОЋШЗЕН![]() ЁЃ
ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁППЩФцЗДгІЃК2NO2![]() 2NO+O2дкУмБеШнЦїЗДгІЃЌДяЕНЦНКтзДЬЌЕФБъжОЪЧЃЈЃЉ
2NO+O2дкУмБеШнЦїЗДгІЃЌДяЕНЦНКтзДЬЌЕФБъжОЪЧЃЈЃЉ
ЃЈ1ЃЉЕЅЮЛЪБМфФкЩњГЩn mol O2ЕФЭЌЪБЩњГЩ2n mol NO2
ЃЈ2ЃЉЕЅЮЛЪБМфФкЩњГЩn mol O2ЕФЭЌЪБЩњГЩ2n mol NO
ЃЈ3ЃЉгУNO2ЁЂNOЁЂO2ЕФЮяжЪЕФСПХЈЖШБфЛЏБэЪОЗДгІЫйТЪЕФБШЮЊ2:2:1ЕФзДЬЌ
ЃЈ4ЃЉЛьКЯЦјЬхЕФбеЩЋВЛдйИФБфЕФзДЬЌ
ЃЈ5ЃЉЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПВЛдйИФБфЕФзДЬЌЃЎ
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛжжЕчЛЏбЇЁАДѓЦјЙЬЬМЁБЕчГиЙЄзїдРэШчЭМЫљЪОЁЃИУЕчГидкГфЕчЪБЃЌЭЈЙ§ДпЛЏМСЕФбЁдёадПижЦЃЌжЛгаLi2CO3ЗЂЩњбѕЛЏЃЌЪЭЗХГіCO2КЭO2ЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
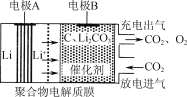
A.ИУЕчГиЗХЕчЪБЕФе§МЋЗДгІЮЊ2LiЃ2eЃЃЋCO32Ѓ=Li2CO3
B.ИУЕчГиМШПЩбЁгУКЌЫЎЕчНтвКЃЌвВПЩбЁЮоЫЎЕчНтвК
C.ГфЕчЪБбєМЋЗЂЩњЕФЗДгІЮЊCЃЋ2Li2CO3Ѓ4eЃ=3CO2ЃЋ4LiЃЋ
D.ИУЕчГиУПЗХЁЂГф4 molЕчзгвЛДЮЃЌРэТлЩЯФмЙЬЖЈ1 mol CO2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЭЌЮТЭЌбЙЯТЃЌгажЪСПЯрЭЌЕФCO2ЁЂH2ЁЂO2ЁЂCH4ЁЂSO2ЮхжжЦјЬхЃЌЯТСагаЙиЫЕЗЈДэЮѓЕФЪЧЃЈ ЃЉ
A.ЦјЬхЕФЬхЛ§гЩДѓЕНаЁЕФЫГађЪЧH2ЃОCH4ЃОO2ЃОCO2ЃОSO2
B.ЫљКЌЗжзгЪ§гЩЖрЕНЩйЕФЫГађЪЧH2ЃОCH4ЃОO2ЃОCO2ЃОSO2
C.УмЖШгЩДѓЕНаЁЕФЫГађЪЧSO2ЃОCO2ЃОO2ЃОCH4ЃОH2
D.ЫљКЌЕчзгЪ§гЩЖрЕНЩйЕФЫГађЪЧCO2ЃОSO2ЃОCH4ЃОO2ЃОH2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП25 ЁцЃЌ101 k PaЪБЃЌЧПЫсгыЧПМюЕФЯЁШмвКЗЂЩњжаКЭЗДгІЕФжаКЭШШЮЊ57.3 kJ/molЃЌаСЭщЕФШМЩеШШЮЊ5518 kJ/molЁЃЯТСаШШЛЏбЇЗНГЬЪНЪщаДе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
A. 2H+(aq) +![]() (aq)+
(aq)+![]() (aq)+2OH
(aq)+2OH![]() (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H![]() O(l);
O(l);![]() H=
H=![]() 57.3 kJ/mol
57.3 kJ/mol
B. KOH(aq)+![]() H
H![]() SO4(aq)=
SO4(aq)=![]() K
K![]() SO4(aq)+H
SO4(aq)+H![]() O(l);
O(l);![]() H=
H=![]() 57.3kJ/mol
57.3kJ/mol
C. C8H18(l)+![]() O
O![]() (g)=8CO
(g)=8CO![]() (g)+ 9H
(g)+ 9H![]() O;
O;![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
D. 2C8H18(g)+25O![]() (g)=16CO
(g)=16CO![]() (g)+18H
(g)+18H![]() O(l);
O(l);![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖдгкПЩФцЗДгІЃКA(g)ЃЋ3B(s)![]() 2C(g)ЃЋ2D(g)ЃЌдкВЛЭЌЬѕМўЯТЕФЗДгІЫйТЪШчЯТЃЌЦфжаБэЪОЕФЗДгІЫйТЪзюДѓЕФЪЧЃЈ ЃЉ
2C(g)ЃЋ2D(g)ЃЌдкВЛЭЌЬѕМўЯТЕФЗДгІЫйТЪШчЯТЃЌЦфжаБэЪОЕФЗДгІЫйТЪзюДѓЕФЪЧЃЈ ЃЉ
A.v(A)ЃН0.5molЁЄLЃ1ЁЄminЃ1B.v(B)ЃН1.2molЁЄLЃ1ЁЄsЃ1
C.v(D)ЃН0.4molЁЄLЃ1ЁЄminЃ1D.v(C)ЃН0.1molЁЄLЃ1ЁЄsЃ1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГаЫШЄаЁзщЕФЭЌбЇЖдвЛХњЬњЕФбљЦЗ(КЌгадгжЪЃЌдгжЪВЛШмгкЫЎЃЌвВВЛгыЯЁСђЫсЗДгІ)НјааЗжЮіЃЌМзЁЂввЁЂБћШ§ЮЛЭЌбЇЗжБ№НјааЪЕбщЃЌЦфжавЛЮЛЭЌбЇЫљгУЕФЯЁСђЫсгыЬњбљЦЗЧЁКУЭъШЋЗДгІЃЌЪЕбщЪ§ОнШчЯТБэЃК
Мз | вв | Бћ | |
ЩеБ+ЯЁСђЫсЕФжЪСП/g | 200 | 150 | 150 |
МгШыЬњЕФбљЦЗЕФжЪСП/g | 9 | 9 | 14 |
ГфЗжЗДгІКѓЃЌЩеБ+ЪЃгрЮяЕФжЪСП/g | 208.7 | 158.7 | 163.7 |
ЧыФуШЯецЗжЮіЪ§ОнЃЌЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉФФЮЛЭЌбЇЫљгУЕФЯЁСђЫсгыЬњЕФбљЦЗЧЁКУЭъШЋЗДгІ_____ЃП
ЃЈ2ЃЉМЦЫуЬњЕФбљЦЗжаЬњЕФжЪСПЗжЪ§_____ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com