

| ʵ���� | T(��) | n(N2)/n(H2) | p(MPa) |
| �� | 450 | 1/3 | 1 |
| �� | �� | �� | 10 |
| �� | 480 | �� | 10 |
 2NH3(g)���ص�,�ڸ���������ͼ2��,��������1 MPa��10 MPa������H2��ת�������¶ȱ仯����������ʾ��ͼ,�������������ߵ�ѹǿ��
2NH3(g)���ص�,�ڸ���������ͼ2��,��������1 MPa��10 MPa������H2��ת�������¶ȱ仯����������ʾ��ͼ,�������������ߵ�ѹǿ��
 2NH3(g)��H="-92" kJ��mol-1��b
2NH3(g)��H="-92" kJ��mol-1��b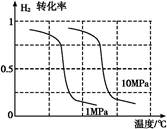
 2NH3(g)����H="-92" kJ��mol-1,��������ܽ��ͷ�Ӧ�Ļ��,��b���߱�ʾ�����˴�����
2NH3(g)����H="-92" kJ��mol-1,��������ܽ��ͷ�Ӧ�Ļ��,��b���߱�ʾ�����˴����� 2NH3(g)
2NH3(g)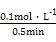 ="0.2" mol��L-1��min-1,K=
="0.2" mol��L-1��min-1,K=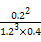 ��0.058,�÷�Ӧ�Ƿ��ȷ�Ӧ,�����¶�ƽ�������ƶ�,K��С��
��0.058,�÷�Ӧ�Ƿ��ȷ�Ӧ,�����¶�ƽ�������ƶ�,K��С�� Ӧ�����
Ӧ����� ,���뢢Ӧ�¶���ͬ,���뢣Ӧѹǿ��ͬ��
,���뢢Ӧ�¶���ͬ,���뢣Ӧѹǿ��ͬ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 O2��HbCO��ʵ�������c(HbCO)��ʹֻ��c(HbO2)��
O2��HbCO��ʵ�������c(HbCO)��ʹֻ��c(HbO2)�� ��Ҳ������˵��������ˡ���֪t ��ʱ������Ӧ��ƽ�ⳣ��K��200������β�O2��Ũ��ԼΪ1.0��10��2 mol��L��1����ʹc(HbCO)С��c(HbO2)��
��Ҳ������˵��������ˡ���֪t ��ʱ������Ӧ��ƽ�ⳣ��K��200������β�O2��Ũ��ԼΪ1.0��10��2 mol��L��1����ʹc(HbCO)С��c(HbO2)�� ��������β�CO��Ũ�Ȳ��ܳ���______mol��L��1��
��������β�CO��Ũ�Ȳ��ܳ���______mol��L��1�� FeO(s)��CO(g)����H��Q1��ƽ�ⳣ��K1
FeO(s)��CO(g)����H��Q1��ƽ�ⳣ��K1 FeO(s)��H2(g)����H��Q2��ƽ�ⳣ��ΪK2
FeO(s)��H2(g)����H��Q2��ƽ�ⳣ��ΪK2 CO(g)��H2O(g)����H��Q3��ƽ�ⳣ��ΪK3
CO(g)��H2O(g)����H��Q3��ƽ�ⳣ��ΪK3| T/�� | K1 | K2 | K3 |
| 700 | 1.47 | 2.38 | 0.62 |
| 900 | 2.15 | 1.67 | |
 CO(g)��H2O(g)Ϊ________(��š�������)�ȷ�Ӧ��Q3________0(�����������������)���۸ı�����ʹ���淴ӦH2(g)��CO2(g)
CO(g)��H2O(g)Ϊ________(��š�������)�ȷ�Ӧ��Q3________0(�����������������)���۸ı�����ʹ���淴ӦH2(g)��CO2(g) CO(g)��H2O(g)�Ѿ�������ƽ�������ƶ����ɲ�ȡ�Ĵ�ʩ��________��
CO(g)��H2O(g)�Ѿ�������ƽ�������ƶ����ɲ�ȡ�Ĵ�ʩ��________���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g)��H2O(g)����H����49.0 kJ��mol��1�����CH3OH�����ʵ�����ʱ��ı仯��ͼ��ʾ����ش��������⣺
CH3OH(g)��H2O(g)����H����49.0 kJ��mol��1�����CH3OH�����ʵ�����ʱ��ı仯��ͼ��ʾ����ش��������⣺

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO2(g)��H2(g)���õ������������ݣ�
CO2(g)��H2(g)���õ������������ݣ�| ʵ���� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1��6 | 2��4 | 6 |
| 2 | 900 | 2 | 1 | 0��4 | 1��6 | 3 |
| 3 | 900 | a | b | c | d | t |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 O2(g)=FeO(s)����H����272.0 kJ��mol��1
O2(g)=FeO(s)����H����272.0 kJ��mol��1 O2(g)=Al2O3(s)����H����1675.7 kJ��mol��1
O2(g)=Al2O3(s)����H����1675.7 kJ��mol��1
 Na2S(s)��4H2O(g)
Na2S(s)��4H2O(g)�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A����������ȼ�ϵ�صĸ�����ӦʽΪO2+2H2O+4e- 4OH- 4OH- |
B���ö��Ե缫��ⱥ��ʳ��ˮʱ,�����ĵ缫��ӦʽΪ2Cl--2e- Cl2�� Cl2�� |
C����ʾ��Ȳȼ���ȵ��Ȼ�ѧ����ʽ:C2H2(g)+ O2(g) O2(g) 2CO2(g)+H2O(g)����H="-1" 256 kJ/mol 2CO2(g)+H2O(g)����H="-1" 256 kJ/mol |
D��M��N��Ϊͬ��������,��M N��H="+119" kJ/mol��֪,N��M�ȶ� N��H="+119" kJ/mol��֪,N��M�ȶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ���� | �� | �� | CO | H2 |
| ȼ����/(kJ��mol��1) | 1 366 | 5 518 | 283 | 286 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 N2��2CO2����÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK��________��
N2��2CO2����÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK��________�� N2(g)��2CO2(g)�Ħ�H��________��
N2(g)��2CO2(g)�Ħ�H��________�� N2(g)��2CO2(g)��NO��Ũ��[c(NO)]���¶�(T)�����������(S)��ʱ��(t)�ı仯���ߡ�
N2(g)��2CO2(g)��NO��Ũ��[c(NO)]���¶�(T)�����������(S)��ʱ��(t)�ı仯���ߡ�
 2N2(g)��3H2O(g)����H<0���ں��ݵ��ܱ������У������й�˵����ȷ����________��
2N2(g)��3H2O(g)����H<0���ں��ݵ��ܱ������У������й�˵����ȷ����________���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com