
【题目】下列化学用语或描述中,正确的是
A.离子结构示意图  既可以表示35Cl-,也可以表示37Cl-
既可以表示35Cl-,也可以表示37Cl-
B.SO3的水溶液能导电,说明SO3是电解质
C.NaHSO3在水中的电离方程式:NaHSO3=Na++H++SO32-
D.同素异形体间的转化和同位素间的转化都是化学变化
科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快 ②NO(g)+NOBr2(g)
NOBr2(g) 快 ②NO(g)+NOBr2(g)![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 正反应的活化能比逆反应的活化能小a kJ·mol-1
D. 增大Br2(g)浓度能增大活化分子百分数, 加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸为二元中强酸,具有较强还原性,且![]() ,下列说法正确的是
,下列说法正确的是![]()
A.草酸与氢氧化钠溶液混合呈中性时,溶液中存在:![]()
B.![]() 与NaClO溶液混合,反应的离子方程式为:
与NaClO溶液混合,反应的离子方程式为:![]()
C.![]() 溶液中:
溶液中:![]()
![]()
![]()
![]()
D.草酸使酸性![]() 溶液褪色,离子方程式为:
溶液褪色,离子方程式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式____________________________
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
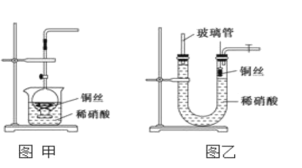
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是______________________________________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是________________________________。
②让反应停止的操作方法及原因是_________________。
(4)以下收集NO气体装置,不合理的是____(填序号)。
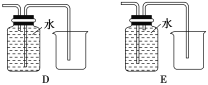
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,科学家合成了含有N![]() 的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈“V”形,如图所示,以下有关该物质的说法中正确的是( )
的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈“V”形,如图所示,以下有关该物质的说法中正确的是( )
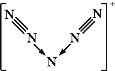
A.每个N![]() 中含有35个质子和36个电子
中含有35个质子和36个电子
B.该离子中有非极性键和配位键
C.该离子中含有2个π键
D.与PCl![]() 互为等电子体
互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2Cr2O7溶液,发生的两个化学反应为①SO2+2Fe3++2H2O→![]() +2Fe2++W,②
+2Fe2++W,②![]() +aFe2++bH+→Cr3++Fe3++H2O。下列有关说法正确的是
+aFe2++bH+→Cr3++Fe3++H2O。下列有关说法正确的是
A.还原性:Cr3+>SO2B.方程式②中,a=6,b=7
C.![]() 能将Na2SO3氧化成Na2SO4D.方程式①中W为OH
能将Na2SO3氧化成Na2SO4D.方程式①中W为OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.16gCH4中含有4NA个CH键
B.标准状况下,22.4L二氯甲烷的分子数约为NA个
C.60g石英晶体所含的氧原子数为4NA
D.1molNa2O2固体中含离子总数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2—二溴乙烷是一种无色液体,有挥发性,有毒,难溶于水,沸点为132℃,密度为2.2gmL-1。某研究性学习小组的同学利用如图(加热装置省略)装置制备一定量的1,2—二溴乙烷,制备原理为:C2H5OH→C2H4→CH2BrCH2Br。Y中的浓硫酸是催化剂、脱水剂,乙醇的密度为0.8gmL-1。
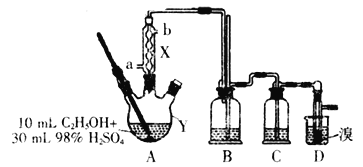
(1)仪器Y的名称是__,由乙醇制备乙烯需要控制温度在170℃,使用X的目的是__,实验中加热A与向X中通入冷却剂的顺序是__。
(2)实验时Y中液体会变成黑色,并有刺激性气味的无机气体产生,变成黑色的原因是__,为吸收反应中生成的无机气体,在装置C中应加入__。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)写出D中反应的化学方程式:__;若产物中有少量未反应的Br2,最好用___洗涤除去。
a.水 b.Na2CO3溶液 c.碘化钠溶液 d.乙醇
(4)该套装置存在一个明显的不足,不足之处是__。
(5)若得到ag1,2—二溴乙烷,所用乙醇的利用率为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z、W的原子序数依次增加,A、B、C、D、E是由这些元素组成的二元化合物,F是元素W的单质。B为一种常见的五核有机物,D常温下呈液态,C、E均能与人体血红蛋白结合使人中毒,上述物质的转化关系如图所示。下列说法正确的

A.原子半径的大小![]()
B.元素Z的氢化物的熔沸点一定比Y的高
C.一定条件下,E和C、D均能发生化学反应
D.Y的最高价氧化物对应的水化物酸性比Z的强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com