
【题目】对H2O2的分解速率影响因素进行研究。在相同温度下,实验测得不同条件下出O2浓度随时间变化如图所示。下列说法不正确的是( )
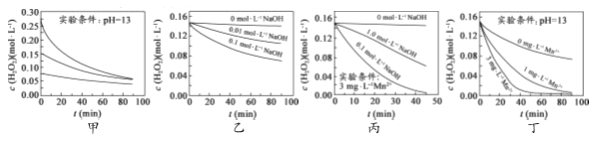
A. 图甲表明,可通过适当增大H2O2浓度,加快H2O2分解速率
B. 图乙表明,可通过调节溶液的酸碱性,控制H2O2分解速率快慢
C. 图丙表明,Mn2+少量存在时,碱性太强,不利于H2O2分解
D. 图乙、图丙和图丁表明,Mn2+是H2O2分解的催化剂,提高Mn2+的浓度就能增大H2O2 分解速率
【答案】D
【解析】A.图甲中溶液的pH相同,但浓度不同,浓度越大,相同时间内浓度的变化量越大,由此得出相同pH条件下,双氧水浓度越大,双氧水分解速率越快,故A正确;B.图乙中H2O2浓度相同,但加入NaOH浓度不同,说明溶液的pH不同,NaOH浓度越大,相同时间内双氧水浓度变化量越大,由此得出:双氧水浓度相同时,pH越大双氧水分解速率越快,故B正确;C.图丙中少量Mn2+存在时,相同时间内双氧水浓度变化量:0.1mol/LNaOH溶液>1.0mol/LNaOH溶液>0mol/LNaOH溶液,由此得出:锰离子作催化剂时受溶液pH的影响,但与溶液的pH值不成正比,碱性太强,不利于H2O2分解,故C正确;D.图丁中pH相同,锰离子浓度越大,相同时间内双氧水浓度变化量越大,但图丙中锰离子作催化剂时受溶液pH的影响,碱性太强,不利于H2O2分解,故D错误;故选D。


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】请根据要求填写下列空白:
(1)NaHCO3溶液呈碱性的原因是 ______________(用方程式和必要文字表示),写出该溶液存在的物料守恒的关系式 ________________。
(2)把AlCl3溶液蒸干、灼烧,最后得到的主要产物是________________________。
(3)若想除去CuCl2 溶液中混有FeCl3杂质,则往往加入试剂 ______________。
①NaOH ②NH3·H2O ③CuO ④CuCO3
(4)在酸碱滴定中,我们用0.1000mol/L HCl来滴定未知浓度的NaOH溶液,①在滴定过程中,操作或说法错误的是_______________。
a.滴定终点为:当滴完最后一滴恰好变色,且在半分钟内不恢复原色
b.进行中和滴定操作时,左手震荡锥形瓶,右手转动活塞控制液滴流速,眼睛要始终注视滴定管内溶液液面的变化
c.酸式滴定管中的盐酸装液前未经润洗,导致所测定的c(NaOH)偏低。
d.酸式滴定管在滴定前有气泡,滴定后气泡消失,导致所测定的c(NaOH)偏高
②某学生根据三次实验分别记录有关数据如下:
滴定次数 | 待测氢氧化钠 溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20mL0.1000mol·L-1氨水用0.1000mol·L-1的盐酸滴定,滴定曲线如图,下列说法正确的是( )
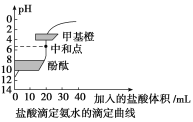
A.该中和滴定适宜用酚酞作指示剂
B.两者恰好中和时,溶液的pH=7
C.达到滴定终点时,溶液中:c(H+)=c(OH-)+c(NH3·H2O)
D.当滴入盐酸达30 mL时,溶液中c(NH4+)+c(H+)<c(OH-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。下列说法不正确的是
实验装置 | 实验编号 | 浸泡液 | pH | 氧气浓度随时间的变化 |
|
|
| 5 |
|
|
| 5 | ||
|
| 7 | ||
|
| 7 |
A.上述正极反应均为![]()
B.在不同溶液中,![]() 是影响吸氧腐蚀速率的主要因素
是影响吸氧腐蚀速率的主要因素
C.向实验![]() 中加入少量
中加入少量![]() 固体,吸氧腐蚀速率加快
固体,吸氧腐蚀速率加快
D.在![]() 内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)写出H2CO3电离方程式_________平衡常数表达式Ka1(H2CO3)=__________________
(2)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为___________
(3)①CH3COO-、②HCO3-、③CO32-、④ClO-结合H+的能力由强到弱的顺序为(注意:用序号①、②、③、④作答)____________________
(4)体积为10mLpH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数__________(填“大于”、“等于”或“小于”)醋酸的平衡常数。
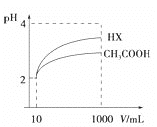
(5)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含SiO2、ZnS、CuS及少量的Fe3O4。某实验小组以该废催化剂为原料,回收锌和铜,设计实验流程如图:
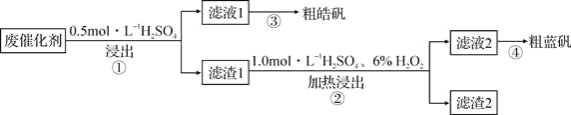
下列说法正确的是( )
A.检验滤液1中是否含有Fe2+,可以选用KSCN和新制的氯水
B.步骤②操作中,应先加6%H2O2,然后不断搅拌下缓慢加入1.0mol/LH2SO4
C.滤渣1成分是SiO2和CuS,滤渣2成分只有SiO2
D.步骤①操作中,生成的气体需用NaOH溶液或CuSO4溶液吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置.下列叙述不正确的是
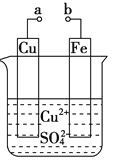
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解
D. a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,二元弱酸H2X溶液中含X微粒的分布分数如图所示。下列叙述正确的是

A. 溶液呈中性时: c(Na+)=2c(X2-)
B. Ka2(H2X)为10-7
C. NaHX溶液c( H+)< c(OH-)
D. 溶液pH由1开至2.6时主要存在的反应是: H2X +OH-=HX-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.在轮船表面涂刷富锌油漆,能有效防止船体在海水中被腐蚀
B.0.1mol·L-1氨水加水稀释后,溶液中![]() 的值减小
的值减小
C.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com