
【题目】分析下列反应在任何温度下均能自发进行的是( )
A.2N2(g)+O2(g)=2N2O(g) ΔH=+163 kJ·mol-1
B.Ag(s)+ ![]() Cl2(g)=AgCl(s) ΔH=-127 kJ·mol-1
Cl2(g)=AgCl(s) ΔH=-127 kJ·mol-1
C.H2O2(l)= ![]() O2(g)+H2O(l) ΔH=-98 kJ·mol-1
O2(g)+H2O(l) ΔH=-98 kJ·mol-1
D.HgO(s)=Hg(l)+ ![]() O2(g) ΔH=+91 kJ·mol-1
O2(g) ΔH=+91 kJ·mol-1
科目:高中化学 来源: 题型:
【题目】在相同温度和压强下,三个容积相同的容器中分别盛有N2、O2、空气,下列说法正确的是( )
A.三种气体质量之比为1∶1∶2B.三种气体的密度之比为1∶1∶1
C.三种气体的分子数之比为1∶1∶1D.三种气体原子数之比为1∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得AlCl3为共价化合物,两个Al—Cl键间的夹角为120°。由此可见,AlCl3属于 ( )
A. 由极性键形成的极性分子
B. 由极性键形成的非极性分子
C. 由非极性键形成的极性分子
D. 由非极性键形成的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 称取7.6g硫酸铜,加入500ml的水, B. 称取8.0g硫酸铜,加水500ml配成溶液。
C. 称取12.0g胆矾,配成500ml溶液, D. 称取12.5g胆矾,配成500ml溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用下图所示的坐标曲线来表示。
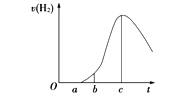
请回答下列问题。
(1)曲线由O→a段不产生氢气的原因是____________________。
有关反应的化学方程式为_________________________。
(2)曲线由a→c段,产生氢气的速率增加较快的主要原因是_______________________________。
(3)曲线由c以后产生氢气的速率逐渐下降的主要原因是_______________________________。
II.某同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液可以加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有:______________、_________________;
(2) 硫酸铜溶液可以加快氢气生成速率的原因:__________________;
(3) 实验中现有Na2SO4、MgSO4、 Ag2SO4、 K2SO4四种溶液,可与上述实验中CuSO4溶液起相似作用的是:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列有关说法正确的是
A. 2.0gH182O与D2O的混合物中所含中子数为NA
B. 标准状况下,22.4L二氯甲烷的分子数约为NA个
C. 1molH2与足量O2反应生成的H2O中含有的共价健总数为NA
D. 在11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4反应中,6molCuSO4能氧化白磷的分子数为1.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)为一元弱酸,广泛用于玻璃、医药、冶金、皮革等工业。回答下列问题:
(1) H3BO3中B元素的化合价为______,其在元素周期表的位置是_________________。
(2)已知:A(OH)3+H2O![]() [Al(OH)4]-+H+,H3BO3的电离方程式为_______。酸性:H3BO3 _____(填*>”或“<”)Al(OH)3。
[Al(OH)4]-+H+,H3BO3的电离方程式为_______。酸性:H3BO3 _____(填*>”或“<”)Al(OH)3。
(3) H3BO3受热分解得到的B2O3和镁粉混合点燃可得单质B,生成单质B的化学方程式为________。
(4) H3BO3可用于生产储氢材料NaBH4。涉及的主要反应为:
I.H3BO3+3CH3OH→B(OCH3)3+3H2O
II.B(OCH3)3+4NaH→NaBH4+3CH3ONa
①“反应I”的类型为__________(填标号)。
A.取代反应 B.加成反应 C.加聚反应 D.氧化反应
②NaH的电子式为_______________。
③在碱性条件下,NaBH4与CuSO4溶液反应可得Cu和Na[B(OH)4],其中H元素由-1价升高为+1价,该反应的离子方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸H2A在水中的电离方程式是H2A = H+ + HA﹣ , HA﹣ ![]() H+ + A2﹣ . 回答下列问题:
H+ + A2﹣ . 回答下列问题:
(1)Na2A溶液显(填“酸性”、“中性”或“碱性”),理由是(用离子方程式或必要的文字说明).
(2)常温下,已知0.1molL﹣1NaHA溶液pH=2,则0.1molL﹣1H2A溶液中氢离子的物质的量浓度可能0.11molL﹣1(填“大于”、“等于”或“小于”),理由是 .
(3)0.1molL﹣1NaHA溶液中各种离子浓度由大到小的顺序是 .
(4)Na2A溶液中,下列表述正确的是_________.
A.c(Na+)+ c(H+)= c(HA﹣)+ 2c(A2﹣)+ c(OH﹣)
B.c(OH﹣)= c(HA﹣)+ c(H+)
C.c(OH﹣)= c(HA﹣)+ c(H+)+ 2c(H2A)
D.c (Na+)= 2[c(HA﹣)+ c(A2﹣) + c(H2A)]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com