
【题目】锌是一种重要的过渡金属,锌及其化合物有着广泛的应用。
(1)指出锌在周期表中的位置:第________周期,第________族,________区。
(2)Zn形成金属晶体,其金属原子堆积属于下列______模式。
A.简单立方 B.钾型 C.镁型 D.铜型
(3)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式________;葡萄糖分子中碳原子的杂化方式为________。
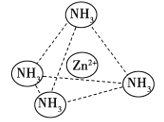
(4)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于________(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,NH3位于正四面体的顶点,试在右下图中表示[Zn(NH3)4]2+中Zn2+与NH3之间的化学键______。
(5)下图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为______________________。该化合物晶体的熔点比干冰高得多,原因是____________________。

(6)与锌同周期,最外层有3个未成对电子的元素名称是________,该元素最高价氧化物对应水化物的酸性比溴的最高价氧化物对应水化物的酸性________(填“强”或“弱”)。
【答案】 四 ⅡB ds C 1s22s22p63s23p63d10或[Ar]3d10 sp2、sp3 极性分子 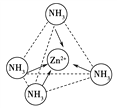 ZnX 该化合物是原子晶体,而干冰是分子晶体 砷 弱
ZnX 该化合物是原子晶体,而干冰是分子晶体 砷 弱
【解析】(1)锌是30号元素,位于第四周期、第ⅡB族,其价电子排布式为3d104s2,所以属于ds区;(2)锌原子堆积属于六方最密堆积,答案选C;(3)Zn失去最外层2个电子形成Zn2+,Zn2+基态电子排布式为1s22s22p63s23p63d10或[Ar]3d10;葡萄糖分子中,饱和碳原子以sp3形式杂化,![]() 中的碳原子以sp2形式杂化。(4)NH3分子呈三角锥形,是极性分子。在[Zn(NH3)4]2+中,Zn2+与NH3之间存在配位键,即
中的碳原子以sp2形式杂化。(4)NH3分子呈三角锥形,是极性分子。在[Zn(NH3)4]2+中,Zn2+与NH3之间存在配位键,即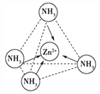 。(5)锌与X元素形成的化合物的晶胞中,N(X):N(Zn)=(8×1/8+6×1/2):4=1:1,所以该化合物的化学式为ZnX。由于该化合物形成的晶体是原子晶体,熔点比干冰(分子晶体)高很多。(6)与锌同周期,最外层有3个未成对电子的元素名称是砷,同周期自左向右非金属性逐渐增强,因此砷元素最高价氧化物对应水化物的酸性比溴的最高价氧化物对应水化物的酸性弱。
。(5)锌与X元素形成的化合物的晶胞中,N(X):N(Zn)=(8×1/8+6×1/2):4=1:1,所以该化合物的化学式为ZnX。由于该化合物形成的晶体是原子晶体,熔点比干冰(分子晶体)高很多。(6)与锌同周期,最外层有3个未成对电子的元素名称是砷,同周期自左向右非金属性逐渐增强,因此砷元素最高价氧化物对应水化物的酸性比溴的最高价氧化物对应水化物的酸性弱。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
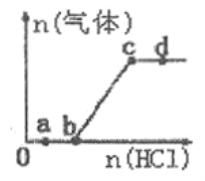
A. a点对应的溶液中:Na+、Ca2+、SO42-、NO3-
B. b点对应的溶液中:K+、Na+、OH-、Cl-
C. c点对应的溶液中: Na+、Ca2+、NO3-、Cl-
D. d点对应的溶液中: Cl-、NO3-、Fe2+、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是一些工厂和矿山废水中的污染元素。常温下,H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与加NaOH溶液调节pH的关系如图所示(已知:pKa=-lgKa),下列说法错误的是
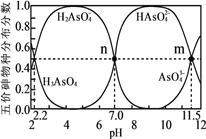
A. Na2HAsO4溶液显碱性
B. H3AsO4溶液pKa2为2.2
C. m点对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1
D. n点对应溶液中离子浓度关系为:c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)依据第2周期元素第一电离能的变化规律,参照下图中B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置_______。

(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2![]() NF3+3NH4F。基态铜原子的核外电子排布式为________。
NF3+3NH4F。基态铜原子的核外电子排布式为________。
(3)BF3与一定量的水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

①晶体Q中各种微粒间的作用力不涉及________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为________,阴离子的中心原子轨道采用________杂化。
(4)已知苯酚![]() 具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子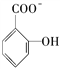 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酸)(填“>”或“<”),其原因是______________________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酸)(填“>”或“<”),其原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 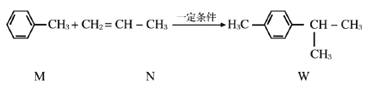 下列说法不正确的是
下列说法不正确的是
A. M、N和W均能发生氧化反应、加成反应和取代反应
B. M不能使溴水因发生化学反应而褪色
C. M与足量的H2反应后的产物的一氯代物有4种
D. W的所有碳原子不可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
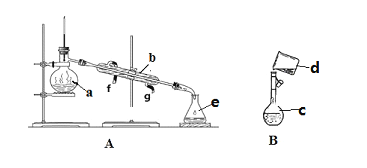
(1)写出下列仪器的名称:a.____________,b.___________,c.__________。
(2)若利用装置分离酒精和水的混合物,还缺少的仪器是______,冷凝水由___口流出(填f或g)。
(3)现需配制0.1mol/LNaOH溶液450mL,装置B是某同学转移溶液的示意图。
①图中的错误是_____________________________。
②根据计算得知,所需NaOH的质量为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
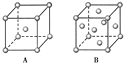
【题目】(1)R单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如下图所示。A中原子堆积方式为________堆积,A、B中R原子的配位数之比为________。
(2)已知单质D为面心立方晶体,如图所示,D的相对原子质量为M,密度为8.9 g/cm3。

试求:
①图中正方形边长=________cm(只列出计算式,NA表示阿伏加德罗常数的值)。
②试计算单质D晶体中原子的空间利用率:________(列出计算式并化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为Kw,该温度下,将浓度为amol/L的一元酸HA与bmol/L的一元碱BOH等体积混合,可判断该溶液呈中性的依据是:
A. a=b
B. 混合溶液的pH值为7
C. 混合溶液中C(H+)=![]()
D. 混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)已知CH4和S的燃烧热分别为a kJ/mol 和b kJ/mol。在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2 和液态水。反应的热化学方程式为______________。(△H用含a、b的代数式表示)
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2 所示:

①分析可知X为_______________(写化学式),0~t1时间段的反应温度为_______________,0~t1时间段用SO2表示的化学反应速率为______________________;
②总反应的化学方程式为___________________________________________;
(3)焦炭催化还原SO2生成S2的化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,lmol/L SO2与足量的焦炭反应,SO2的转化率随温度的变化如图3 所示。
S2(g)+2CO2(g),恒容容器中,lmol/L SO2与足量的焦炭反应,SO2的转化率随温度的变化如图3 所示。
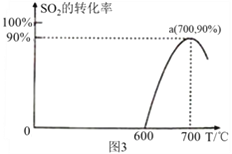
①该反应的ΔH______0(填“>”或“<”);
②700℃的平衡常数为_____________________;
(4)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为___________,25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为___________。(已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com