
【题目】[化学——选修3:物质结构与性质]
氮的化合物在生产、生活中有广泛应用。
(1)氮化镓(GaN)是新型的半导体材料。基态氮原子的核外电子排布图为____;基态镓(Ga)原子的核外具有____种不同能量的电子。
(2)乙二氨的结构简式为(H2N-CH2-CH2-NH2,简写为en)。
①分子中氮原子轨道杂化类型为____;
②乙二氨可与铜离子形成配合离子[Cu(en)2]2+,其中提供孤电子对的原子是____,配合离子结构简式为____;
③乙二氨易溶于水的主要原因是____。
(3)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

①图1中氮原子的配位数为____,离硼原子最近且等距离的硼原子有____个;
②已知六方氮化硼同层中B与N之间的距离为acm,密度为dgcm-3,则相邻层与层之间的距离为____pm(列出表达式)。
【答案】![]() 8 sp3 N
8 sp3 N 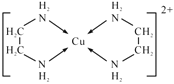 乙二氨与水形成分子间氢键,乙二氨分子与水分子均为极性分子 4 12
乙二氨与水形成分子间氢键,乙二氨分子与水分子均为极性分子 4 12 ![]() 1010
1010
【解析】
(1)氮原子核外有7个电子,电子排布式为1s22s22p3;镓为31号元素,电子排布式为1s22s22p63s23p63d104s24p1,依据电子排布式解答;
(2)①H2N-CH2-CH2-NH2中氮原子的价层电子对数为![]() (5+3)=4;
(5+3)=4;
②中心原子Cu2+提供空轨道,乙二氨分子中N原子提供孤对电子;
③乙二氨和水都是极性分子,相似相溶,乙二氨分子与水分子间可形成氢键。
(3)①观察晶胞结构发现N原子周围距离最近的B数目为4,即配位数为4;由图可知,晶胞为面心立方堆积,以顶点的N原子分析,位于面心的原子与之相邻,1个顶点原子为12个面共用,所以离N原子最近且等距离的N原子有12个,同理离硼原子最近且等距离的硼原子有12个;
②每个六棱柱平均含有一个N原子和一个B原子,两原子的相对原子质量之和为25,设层与层之间距离为h,六棱柱体积为![]() a2hcm3,六棱柱质量为
a2hcm3,六棱柱质量为![]() =
=![]() a2hdg,所以h=
a2hdg,所以h=![]() cm=
cm=![]() ×1010pm。
×1010pm。
(1)氮原子核外有7个电子,基态氮原子的核外电子排布图为![]() ;镓为31号元素,电子排布式为1s22s22p63s23p63d104s24p1,有8个不同的能层,所以基态镓(Ga)原子的核外具有8种不同能量的电子。
;镓为31号元素,电子排布式为1s22s22p63s23p63d104s24p1,有8个不同的能层,所以基态镓(Ga)原子的核外具有8种不同能量的电子。
故答案为:![]() ;8;
;8;
(2)①H2N-CH2-CH2-NH2中氮原子的价层电子对数为![]() (5+3)=4,所以轨道杂化类型为sp3;
(5+3)=4,所以轨道杂化类型为sp3;
②配合离子[Cu(en)2]2+中心原子Cu2+提供空轨道,乙二氨分子中N原子提供孤对电子,因此提供孤电子对的原子是N,配合离子结构简式为 ;
;
③乙二氨和水都是极性分子,相似相溶,乙二氨分子与水分子间可形成氢键,所以乙二氨易溶于水。
故答案为:sp3;N; ;乙二氨与水形成分子间氢键,乙二氨分子与水分子均为极性分子;
;乙二氨与水形成分子间氢键,乙二氨分子与水分子均为极性分子;
(3)①观察晶胞结构发现N原子周围距离最近的B数目为4,即配位数为4;由图可知,晶胞为面心立方堆积,以顶点的N原子分析,位于面心的原子与之相邻,1个顶点原子为12个面共用,所以离N原子最近且等距离的N原子有12个,同理离硼原子最近且等距离的硼原子有12个;
②选取晶体结构中最小的正六棱柱为计算单位,根据均摊法可以计算出每个六棱柱平均含有一个N原子和一个B原子,两原子的相对原子质量之和为25。已知六方氮化硼同层中B与N之间的距离为acm,则正六边形的边长为acm,设层与层之间距离为h,六棱柱体积为![]() a2hcm3,又知其密度为dgcm-3,则六棱柱质量为
a2hcm3,又知其密度为dgcm-3,则六棱柱质量为![]() =
=![]() a2hd g,所以h=
a2hd g,所以h=![]() cm=
cm=![]() ×1010pm,则层与层之间距离的计算表达式为
×1010pm,则层与层之间距离的计算表达式为![]() ×1010pm。
×1010pm。
故答案为:4;12;![]() 1010。
1010。


科目:高中化学 来源: 题型:
【题目】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
| C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯, 易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 易升华 | |
沸点/℃ | 132 | 173 | ||
(1)用H2还原无水FeCl3制取FeCl2。有关装置如下:

①H2还原无水FeCl3制取FeCl2的化学方程式为_____________。
②按气流由左到右的方向,上述仪器的连接顺序为_________(填字母,装置可多次使用);C中盛放的试剂是_____________。
③该制备装置的缺点为________________。
(2)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按下图装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。

①仪器a的名称是__________。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是____,回收滤液中C6H5C1的操作方法是______。
③反应后将锥形瓶中溶液配成250mL,量取25.00mL所配溶液,用0.40mol/LNaOH溶液滴定,终点时消耗NaOH溶液为19.60 mL,则氯化铁的转化率为__________。
④为了减少实验误差,在制取无水FeCl2过程中应采取的措施有:________(写出一点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某高能锂离子电池的总反应为:2Li+FeS= Fe +Li2S,电解液为含LiPF6.SO(CH3)2的有机溶液(Li+可自由通过)。某小组以该电池为电源电解废水并获得单质镍,工作原理如图所示。

下列分析正确的是
A. 该锂离子电池正极反应为FeS+2Li++2e-=Fe +Li2S
B. X与电池的Li电极相连
C. 电解过程中c(BaC12)保持不变
D. 若去掉阳离子膜将左右两室合并,则X电极的反应不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
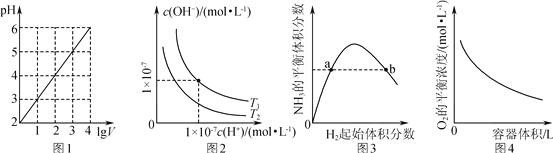
A. 图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化
B. 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1
C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D. 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s) ![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠常用作漂白剂。某化学小组设计实验制备亚氯酸钠,并进行杂质分析。
实验I 按图装置制备NaC1O2晶体

已知:①C1O2为黄绿色气体,极易与水反应。
②NaC1O2饱和溶液在低于38℃时析出NaC1O2·3H2O晶体,高于38℃时析出NaC1O2晶体,温度高于60℃时NaC1O2分解生成NaC1O3和NaCl。
(1)装置A中b仪器的名称是____;a中能否用稀硫酸代替浓硫酸____(填“能”或“不能”),原因是____。
(2)A中生成C1O2的化学反应方程式为____。
(3)C中生成NaC1O2时H2O2的作用是____;为获得更多的NaC1O2,需在C处添加装置进行改进,措施为____。
(4)反应后,经下列步骤可从C装置的溶液中获得NaC1O2晶体,请补充完善。
i.55℃时蒸发结晶 ii.__________ ii.用40℃热水洗涤 iv.低于60℃干燥,得到成品
实验Ⅱ 样品杂质分析
(5)上述实验中制得的NaC1O2晶体中还可能含有少量中学常见的含硫钠盐,其化学式为____,实验中可减少该杂质产生的操作(或方法)是____(写一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据反应2KIO3+5SO2+4H2O═I2+3H2SO4+2KHSO4(KIO3过量),利用下列装置从反应后的溶液中制取碘的CCl4溶液并回收KHSO4。下列说法不正确的是
A. 用 制取SO2B. 用
制取SO2B. 用 还原IO3-
还原IO3-
C. 用 从水溶液中提取KHSO4D. 用
从水溶液中提取KHSO4D. 用 制取I2的CCl4溶液
制取I2的CCl4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物R是金银花的一种成分,具有广谱抗病毒功效,键线式为 (已知CH2=CHCH2OH的键线式为
(已知CH2=CHCH2OH的键线式为![]() )。下列说法错误的是( )
)。下列说法错误的是( )
A.R能发生加成、氧化、取代反应
B.用酸性高锰酸钾溶液可以确认R含碳碳双键
C.R分子中所有碳原子可能共平面
D.![]() CHO与R互为同分异构体
CHO与R互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列叙述中,正确的是( )
A.氧气的摩尔质量是32
B.2molNaCl固体溶解于1L水所得溶液的物质的量浓度为2mol/L
C.标准状况下同体积的O2和O3中所含分子数相等
D.在标准状况下,体积为22.4L的物质都是1mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com