
【题目】已知:2Al+3Cl2=2AlCl3,无水氯化铝遇潮湿的空气即产生大量白雾,实验室可用下列装置按一定的顺序连接,制备无水氯化铝。
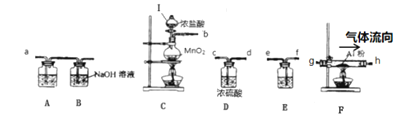
(1)写出仪器Ⅰ的名称___。装置C中发生反应的化学方程式为___。
(2)为达到实验目的,装置的连接顺序为(用字母“a”~“h”填写):b→___→a。
(3)装置A盛放的试剂是___;装置E中盛放的试剂是___。装置B的作用是___。
(4)装置C的气密性检查的操作是___。
【答案】分液漏斗 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O fecdgh 浓硫酸 饱和食盐水 吸收尾气氯气,防止污染空气 法1:将导管b接一长导管插入水中,关闭分液漏斗旋塞,加热圆底烧瓶,导管口有气泡冒出,移去酒精灯,冷却后,导管口形成一段稳定的水柱,则气密性良好。法2:在导管口接一橡皮管,用止水夹夹住,打开分液漏斗旋塞,向分液漏斗中加水,水流下一段后不再流下,则气密性良好。
MnCl2+Cl2↑+2H2O fecdgh 浓硫酸 饱和食盐水 吸收尾气氯气,防止污染空气 法1:将导管b接一长导管插入水中,关闭分液漏斗旋塞,加热圆底烧瓶,导管口有气泡冒出,移去酒精灯,冷却后,导管口形成一段稳定的水柱,则气密性良好。法2:在导管口接一橡皮管,用止水夹夹住,打开分液漏斗旋塞,向分液漏斗中加水,水流下一段后不再流下,则气密性良好。
【解析】
本实验要用2Al+3Cl2=2AlCl3这一反应原理制备无水氯化铝,氯气需要现制。C装置用来制备氯气,制备原理为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,这一过程中会产生杂质HCl气体和水蒸气,金属铝可以和HCl反应,题中给出信息无水氯化铝遇潮湿的空气即产生大量白雾,所以在氯气进入F装置前需要把水蒸汽和HCl除掉,可以用浓硫酸吸水,用饱和氯化钠溶液除HCl气体。氯气有毒不能直接排放到空气中,所以F装置中氯气和铝反应以后,剩余的氯气要用NaOH溶液吸收,为防止NaOH溶液中水蒸气进入F装置,F要先连接干燥装置A再连尾气处理装置B,干燥装置A中仍然可以用浓硫酸干燥。依据上述进行解答。
MnCl2+Cl2↑+2H2O,这一过程中会产生杂质HCl气体和水蒸气,金属铝可以和HCl反应,题中给出信息无水氯化铝遇潮湿的空气即产生大量白雾,所以在氯气进入F装置前需要把水蒸汽和HCl除掉,可以用浓硫酸吸水,用饱和氯化钠溶液除HCl气体。氯气有毒不能直接排放到空气中,所以F装置中氯气和铝反应以后,剩余的氯气要用NaOH溶液吸收,为防止NaOH溶液中水蒸气进入F装置,F要先连接干燥装置A再连尾气处理装置B,干燥装置A中仍然可以用浓硫酸干燥。依据上述进行解答。
(1)仪器Ⅰ的名称是分液漏斗,装置C是制备氯气过程,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
答案为:分液漏斗;MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)C装置制备氯气,E装置除HCl气体,D装置干燥氯气,F装置制备无水氯化铝,A装置除水蒸气,B装置进行尾气处理。装置的连接顺序为:CEDFAB。洗气时导管要长进短出,所以装置的导管连接顺序为:fecdgh;
答案为:fecdgh;
(3)A装置除水蒸气,试剂用浓硫酸。E装置除HCl气体,试剂用饱和食盐水。B装置中的NaOH溶液可以吸收尾气氯气,防止污染空气;
答案为:浓硫酸 ; 饱和食盐水 ; 吸收尾气氯气,防止污染空气;
(4)装置C的气密性检查的操作依据装置内气体受热压强增大的原理来解答。
答案为:法1:将导管b接一长导管插入水中,关闭分液漏斗旋塞,加热圆底烧瓶,导管口有气泡冒出,移去酒精灯,冷却后,导管口形成一段稳定的水柱,则气密性良好。法2:在导管口接一橡皮管,用止水夹夹住,打开分液漏斗旋塞,向分液漏斗中加水,水流下一段后不再流下,则气密性良好。


科目:高中化学 来源: 题型:
【题目】如图所示是探究铁发生腐蚀的装置图。发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升。下列说法中不正确的是( )
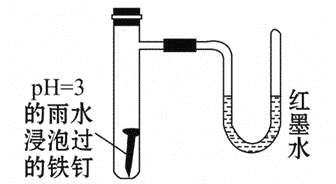
A.开始时发生的是析氢腐蚀
B.一段时间后发生的是吸氧腐蚀
C.两种腐蚀负极的电极反应式均为Fe-2e-=Fe2+
D.析氢腐蚀的总反应式为2Fe+O2+2H2O=2Fe(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学平衡常数的描述中正确的是( )
A. 化学平衡常数的大小取决于化学反应本身,与其他外界条件无关
B. 相同温度下,反应A+BC与反应CA+B的化学平衡常数相同
C. 反应2SO2(g)+O2(g)2SO3(g) ΔH<0的化学平衡常数随温度升高而增大
D. 反应A(g)+B(g)2C(g)的平衡常数表达式为K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) (CH3CH2)2CHCH3的正确命名是______________,该烃是某炔烃经催化加氢后得到,那么炔烃的结构简式是__________ ,正确命名是____________。
(2)苯酚和浓溴水反应:_________,反应类型____________。
(3)(CH3)2C(OH)CH(OH)CH2OH发生催化氧化反应:_________。
(4)两种饱和一元脂肪醛的混合物,其平均相对分子质量为51。取4.08 g混合物与足量银氨溶液共热,生成银21.6 g。试通过计算判断这两种醛的物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如下所示。
达到平衡,正反应速率随时间变化的示意图如下所示。
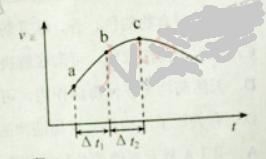
A. 反应在c 点达到平衡状态
B. 反应物浓度:![]() 点小于
点小于![]() 点
点
C. 反应物的总能量低于生成物的总能量
D. ![]() 时,SO2的转化率:
时,SO2的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. (1)写出表示含有 8 个质子、10 个中子的原子的化学符号_____。
(2)原子种类由_________决定;元素种类由_____决定;元素的 同位素由_____决定;元素的化学性质由_________决定。
Ⅱ.有①![]() 、
、![]() 、
、![]() ②H2O、D2O ③石墨、金刚石④H、D、T 四组微粒或物质,回答下列问题:
②H2O、D2O ③石墨、金刚石④H、D、T 四组微粒或物质,回答下列问题:
(1)互为同位素的是_____;
(2)互为同素异形体的是_________;
(3)由①和④中微粒能结合成含三个原子的化合物,这些化合 物中相对分子质量最大的是_________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或离子方程式中,正确的是:
A.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将0.5mol N2和1.5molH2置 于密闭的窗口中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:![]() △H=-38.6kJ·mol-1
△H=-38.6kJ·mol-1
C.氯化镁溶液与氨水反应:![]()
D.钢铁腐蚀时可能发生的正极反应:2H2O+ O2+ 4e-=4OH一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A(g)和2 mol B(g)在2 L的恒容密闭容器中混合并在一定条件下发生反应:2A(g)+B(g) 2C(g) ΔH<0,反应2 s后测得C的浓度为0.6 mol·L-1。下列说法正确的是
A.2 s后物质A的转化率为70%
B.当各物质浓度满足c(A)=2c(B)=c(C)时,该反应达到了平衡状态
C.达到平衡状态时,增加A的物质的量,A和B的转化率都提高
D.达到平衡状态时,升高温度,平衡逆向移动,同时化学平衡常数K减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置来验证同主族元素非金属性的变化规律。
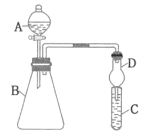
要证明非金属性:Cl>I,在A中加入浓盐酸,B中加入KMnO4(KMnO4与浓盐酸在常温下反应生成氯气),C中加入___溶液,观察到C中___(填实验现象),即可证明。干燥管D的作用是___。从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用___溶液吸收尾气。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com