
| 2mol×0.01mol |
| 6mol |
| 1 |
| 300 |
| 1 |
| 300 |
| 67.2L×0.01mol |
| 6mol |
| 6mol×0.01mol |
| 6mol |


科目:高中化学 来源: 题型:
| 混合物 | 碱 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | 液态氯气 | 苛性钠 | 硫酸铜 | 氧化铁 | 二氧化碳 |
| B | 氯水 | 烧碱 | 食盐 | 氧化钠 | 氧化铝 |
| C | 84消毒液 | 纯碱 | 石灰石 | 氨气 | 水 |
| D | 洁净的空气 | 熟石灰 | 苏打 | 生石灰 | 二氧化硫 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
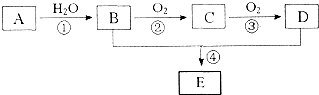
查看答案和解析>>
科目:高中化学 来源: 题型:

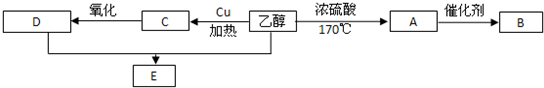
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、产物B的状态一定为气态 |
| B、平衡时,单位时间内消耗n(A)与消耗n(C)相等 |
| C、保持体积不变,向平衡体系中加入B平衡向逆反应方向移动 |
| D、若开始时向容器中加入1molB和1molC,达到平衡时放出热量QkJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X和Y两种元素构成一种阴离子,该阴离子与强酸反应时,可能变成Y的阳离子 |
| B、元素Y的最高价氧化物能溶于Z的最高价氧化物的水化物中 |
| C、X、Y和Z三元素组成的化合物为碱 |
| D、X与Z的单质在不同条件下能生成不同的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com