
【题目】有学生将铜与稀硝酸反应实验及NO、NO2性质实验进行改进、整合,装置如图(洗耳球:一种橡胶为材质的工具仪器)。

实验步骤如下:
(一)组装仪器:按照如图装置连接好仪器,关闭所有止水夹;
(二)加入药品:在装置A中的烧杯中加入30%的氢氧化钠溶液,连接好铜丝,在装置C的U型管中加入4.0 mol/L的硝酸,排除U型管左端管内空气;
(三)发生反应:将铜丝向下移动,在硝酸与铜丝接触时可以看到螺旋状铜丝与稀硝酸反应产生气泡,此时打开止水夹①,U型管左端有无色气体产生,硝酸左边液面下降与铜丝脱离接触,反应停止;进行适当的操作,使装置C中产生的气体进入装置B的广口瓶中,气体变为红棕色;
(四)尾气处理:气体进入烧杯中与氢氧化钠溶液反应;
(五)实验再重复进行。
回答下列问题:
(1)实验中要保证装置气密性良好,检验其气密性操作应该在____。
a.步骤(一)(二)之间 b.步骤(二)(三)之间
(2)装置A的烧杯中玻璃仪器的名称是____。
(3)加入稀硝酸,排除U型管左端管内空气的操作是________。
(4)步骤(三)中“进行适当的操作”是打开止水夹____(填写序号),并用洗耳球在U型管右端导管口挤压空气进入。
(5)在尾气处理阶段,使B中广口瓶内气体进入烧杯中的操作是____。尾气中主要含有NO2和空气,与NaOH溶液反应只生成一种盐,则离子方程式为 ___。
(6)某同学发现,本实验结束后硝酸还有很多剩余,请你改进实验,使能达到预期实验目的,反应结束后硝酸的剩余量尽可能较少,你的改进是_____。
【答案】a 球形干燥管 加入硝酸时,不断向左端倾斜U型管 ②③ 打开止水夹④,关闭止水夹②,并将洗耳球尖嘴插在止水夹③处的导管上,打开止水夹挤压洗耳球 4NO2+O2+4OH-=4NO3-+2H2O 取少量的稀硝酸和四氯化碳注入U型管中
【解析】
(1)气密性检验在连接好装置之后,加药品之前;
(2)根据装置的形状分析判断;
(3)根据实验的目的分析;
(4) 使装置C中产生的气体进入装置B的广口瓶中,必须保持气流畅通;
(5)尾气处理阶段需要让氮氧化物进入氢氧化钠溶液中,必须打开止水夹④,并关闭②,并将气体压入装置A;根据反应物主要是NO2和O2,产物只有一种盐,说明只有NaNO3。
(6)要考虑硝酸浓度越低,反应越慢,该反应又没有加热装置,不可取,最好是放入四氯化碳,密度比硝酸溶液大,且难溶于水,反应后通过分液便于分离。
(1)气密性检验在连接好装置之后,加药品之前,故答案选a;
(2)根据装置中仪器的形状,可以判定该装置为球形干燥管或干燥管;
(3)根据实验目的是铜和稀硝酸反应的性质实验,加入硝酸时,不断向左端倾斜U型管;
(4)使装置C中产生的气体进入装置B的广口瓶中,必须保持气流畅通,气体若进入三孔洗气瓶,在需要打开②③,只打开②,气体也很难进入,因为整个体系是密封状态,需用洗耳球尖嘴插在止水夹③处的导管上,打开止水夹挤压洗耳球;
(5)尾气处理阶段需要让氮氧化物进入氢氧化钠溶液中,必须打开止水夹④,并关闭②,并通过③通入空气,排出氮氧化物;根据反应物主要是NO2和O2,产物只有一种盐,说明只有NaNO3,方程式为:4NO2+O2+4OH-=4NO3-+2H2O;
(6)硝酸浓度越低,反应越慢,该反应又没有加热装置,最好是放入四氯化碳,密度比硝酸溶液大,且难溶于水,反应后通过分液便于分离,则改进的方法为取少量的稀硝酸和四氯化碳注入U型管中,二者不互溶,可填充U型管的空间不改变硝酸的浓度。


科目:高中化学 来源: 题型:
【题目】(1)锂空气电池比传统的锂离子电池拥有更强的蓄电能力,是传统锂离子电池容量的10倍,其工作原理示意图如图。

放电时,b电极为电源的__极,电极反应式为__。
(2)汽车尾气中CO、NO2在一定条件下可发生反应4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g),一定温度下,向容积固定的2L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示。
4CO2(g)+N2(g),一定温度下,向容积固定的2L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示。

①0~10min内该反应的平均反应速率v(CO)=__。
②恒温恒容条件下,不能说明该反应已经达到平衡状态的是__(填序号)。
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.容器内混合气体密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
Ⅰ.铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如图:

(1)写出反应1中涉及的任意一个化学方程式____;
(2)滤液Ⅰ中加入CaO生成的沉淀是____,已知气体A在标准状况下的密度为1.96g/L,写出A过量时,反应2的离子方程式____;
Ⅱ.以萤石(CaF2)和纯碱为原料制备冰晶石的流程如图:

(3)萤石(CaF2)的电子式____;
(4)若E为硫酸钙,D为最稳定的气态氢化物,则化合物C是____,写出由D制备冰晶石(Na3AlF6)的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,正确的是
A.甲烷的燃烧热△H =-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =-890.3 kJ·mol-1
B.一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3放热akJ,其热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) △H =-2a kJ·mol-1
2NH3(g) △H =-2a kJ·mol-1
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则水分解的热化学方程式表示为:2H2O(l) =2H2(g)+O2(g) △H =-571.6 kJ·mol-1
D.HCl和NaOH反应中和热△H =-57.3 kJ·mol-1,则CH3COOH和NaOH反应生成1mol水时放出的热量小于57.3KJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2是工业上最常用的合成气,该合成气的制备方法很多,它们也能合成许多重要的有机物。回答下列问题:
(1)制备该合成气的一种方法是以CH4和H2O为原料,有关反应的能量变化如图所示。
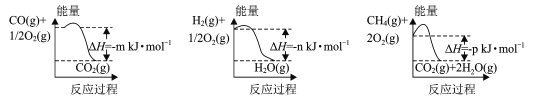
CH4 (g)与H2O(g)反应生成CO(g)和H2 (g)的热化学方程式为____。
(2)工业乙醇也可用CO和H2合成,常含一定量甲醇,各国严禁使用成本低廉的工业酒精勾兑食用酒,但一般定性的方法很难检测出食用酒中的甲醇。有人就用硫酸酸化的橙色K2Cr2O7溶液定量测定混合物中甲醇的含量,甲醇与酸性K2Cr2O7溶液反应生成CO2、Cr2(SO4)3等物质,写出其化学方程式 ___________。
(3)为了检验由CO和H2合成气合成的某有机物M的组成,进行了如下测定:将1.84gM在氧气中充分燃烧,将生成的气体混合物通过足量的碱石灰,碱石灰 增重4. 08 g,又知生成CO2和H2O的物质的量之比为3:4。则M中碳、氢、氧原子个数之比为____。
(4) CO2和H2合成甲醇涉及以下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) H=-49.58kJ/mol。在反应过程中可以在恒压的密闭容器中,充入一定量的CO2和H2,测得不同温度下,体系中CO2的平衡转化率与压强的关系曲线如图所示:
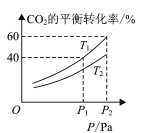
①反应过程中,表明反应达到平衡状态的标志是______;
A.生成3mol O-H键,同时断裂3mol H-H键 B.容器中气体的压强不再变化
C.容器中气体的平均摩尔质量不变 D.CH3OH的浓度不再改变
②比较T1与T2的大小关系:T1 ___T2 (填“<”、“=”或“>”)。
③在T1和P2的条件下,向密闭容器中充入1mol CO2和3mol H2,该反应在第5 min时达到平衡,此时容器的容积为2.4 L,则该反应在此温度下的平衡常数为____,保持T1和此时容器的容积不变,再充入1mol CO2和3mol H2,设达到平衡时CO2的总转化率为a,写出一个能够解出a的方程或式子 ___(不必化简,可以不带单位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无机盐X(仅含三种元素,原子个数比为1:1:4,摩尔质量270g·mol-1),为探究其组成和性质,某学习小组进行了如下实验,X与水反应只生成A、B两种物质,其中气体单质 A 能使带火星的木条复燃。下列说法正确的是:

(1)X的组成元素为 O和_____________(用元素符号表示)。
(2)X 的 化学式为____________。
(3)下列说法正确的是(NA为阿伏加德罗常数)_________ 。
a.酸式盐B的焰色反应颜色可以直接观察
b.盐X中的两种非金属元素所组成的氧化物都能使酸性高锰酸钾溶液褪色
c.1摩尔的固体B中含2NA个离子
d.氮气和气体单质A点燃即可发生反应
(4)X氧化能力极强,可用于脱硫脱硝,写出在碱性条件下X氧化SO32-的离子方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,组成甲、乙两个装置(如图)。下列说法不正确的是

A.甲为原电池,负极反应为Zn-2e-=Zn2+
B.甲为原电池,Fe电极上有气体放出
C.乙为电解池,阴极反应式为2H++2e-=H2↑
D.一段时间后,甲、乙两表面皿中溶液均有红色出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用辉铜矿(主要成分为![]() ,含少量
,含少量![]() 、
、![]() 等杂质)制备难溶于水的碱式碳酸铜的流程如图所示:
等杂质)制备难溶于水的碱式碳酸铜的流程如图所示:

(1)下列措施无法加快浸取速率的是________(填字母)。
A.延长浸取时间 B.将辉铜矿粉碎 C.充分搅拌 D.适当增大硫酸浓度
(2)滤渣Ⅰ中的主要成分是![]() 、S、
、S、![]() ,请写出“浸取”反应中生成S的离子方程式:_________________________。
,请写出“浸取”反应中生成S的离子方程式:_________________________。
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,原因可能是__________________________。
(4)“沉锰”(除![]() )过程中有关反应的离子方程式为________________________________。
)过程中有关反应的离子方程式为________________________________。
(5)滤液Ⅱ经蒸发结晶得到的盐主要是___________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸具有止血功效,存在于多种中药中,其结构简式如下图,下列说法不正确的是
![]()
A. 咖啡酸可以发生取代、加成、氧化、酯化、加聚反应
B. 1mol 咖啡酸最多能与5 mol H2反应
C. 咖啡酸分子中所有原子可能共面
D. 蜂胶的分子式为C17H16O4,在一定条件下可水解生成咖啡酸和一种一元醇A,则醇A 的分子式为C8H10O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com