
【题目】有研究人员在体外实验中发现药物瑞德西韦对新冠病毒有明显抑制作用。E是合成瑞德西韦的中间体,其合成路线如下:
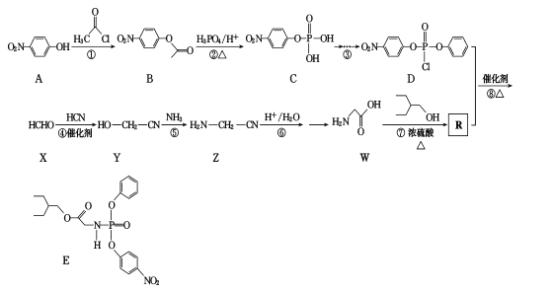
回答下列问题:
(1)W的化学名称为____;反应①的反应类型为____
(2)A中含氧官能团的名称为____。
(3)写出反应⑦的化学方程式_____
(4)满足下列条件的B的同分异构体有____种(不包括立体异构)。
①苯的二取代物且苯环上含有硝基;②可以发生水解反应。
上述同分异构体中核磁共振氢谱为3:2:2的结构简式为____________
(5)有机物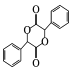 中手性碳(已知与4个不同的原子或原子团相连的碳原子称为手性碳)有 ___个。结合题给信息和已学知识,设计由苯甲醇为原料制备
中手性碳(已知与4个不同的原子或原子团相连的碳原子称为手性碳)有 ___个。结合题给信息和已学知识,设计由苯甲醇为原料制备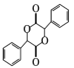 的合成路线_______ (无机试剂任选)。
的合成路线_______ (无机试剂任选)。
【答案】氨基乙酸 取代反应 硝基和羟基 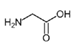 +
+
![]()
 +H2O 8
+H2O 8 ![]() 2
2 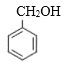
![]()
![]()
![]()
![]()
![]()
【解析】
根据流程图,A(![]() )和
)和![]() 发生取代反应生成B(
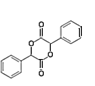
发生取代反应生成B(![]() ),B和磷酸在加热条件下发生取代生成C,C在一定条件下转化为
),B和磷酸在加热条件下发生取代生成C,C在一定条件下转化为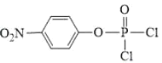 ,
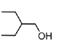
, 中的一个氯原子被取代转化为D;X与HCN发生加成反应生成Y,Y和氨气在一定条件下发生取代反应生成Z,Z在酸性条件下水解得到W,D和R在一定条件下反应生成E,根据E和D的结构简式,可推出R的结构简式为
中的一个氯原子被取代转化为D;X与HCN发生加成反应生成Y,Y和氨气在一定条件下发生取代反应生成Z,Z在酸性条件下水解得到W,D和R在一定条件下反应生成E,根据E和D的结构简式,可推出R的结构简式为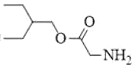 ,由此可知W和
,由此可知W和![]() 在浓硫酸加热条件下发生酯化反应生成R,据此分析解答。
在浓硫酸加热条件下发生酯化反应生成R,据此分析解答。
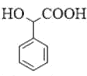
(1)W的结构简式为![]() ,结构中有羧基和氨基,化学名称为氨基乙酸;根据分析,反应①为A(
,结构中有羧基和氨基,化学名称为氨基乙酸;根据分析,反应①为A(![]() )和
)和![]() 发生取代反应生成B(
发生取代反应生成B(![]() ),反应类型为取代反应;
),反应类型为取代反应;
(2)A的结构简式为![]() ,含氧官能团的名称为硝基和羟基;
,含氧官能团的名称为硝基和羟基;
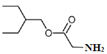
(3)根据分析,反应⑦为W和![]() 在浓硫酸加热条件下发生酯化反应生成R,R的结构简式为
在浓硫酸加热条件下发生酯化反应生成R,R的结构简式为 ,化学方程式
,化学方程式 +
+
![]()
 +H2O;
+H2O;
(4)B的结构简式为![]() ,①苯的二取代物且苯环上含有硝基;②可以发生水解反应,说明另一个取代基为酯基,该酯基的结构可为-OOCCH3或-COOCH3或-CH2OOCH,在苯环上与硝基分别有邻间对三种位置,分别为:
,①苯的二取代物且苯环上含有硝基;②可以发生水解反应,说明另一个取代基为酯基,该酯基的结构可为-OOCCH3或-COOCH3或-CH2OOCH,在苯环上与硝基分别有邻间对三种位置,分别为: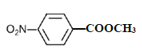 、
、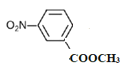 、
、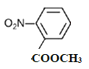 、
、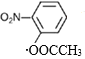 、
、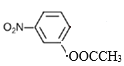 、
、![]() 、
、![]() 、
、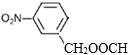 、
、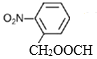 ,除去自身外结构外,共有8种; 上述同分异构体中核磁共振氢谱为3:2:2,说明分子中含有三种不同环境的氢原子且个数比为3:2:2,则符合要求的结构简式为
,除去自身外结构外,共有8种; 上述同分异构体中核磁共振氢谱为3:2:2,说明分子中含有三种不同环境的氢原子且个数比为3:2:2,则符合要求的结构简式为![]() ;
;
(5)已知与4个不同的原子或原子团相连的碳原子称为手性碳,有机物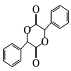 中手性碳的位置为
中手性碳的位置为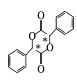 ,有2个;
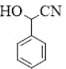
,有2个;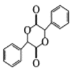 的水解产物为
的水解产物为 ,
, 的结构中的-COOH可由-CN酸性条件下水解得到,而
的结构中的-COOH可由-CN酸性条件下水解得到,而![]() 与HCN发生加成反应可生成
与HCN发生加成反应可生成 ,再结合苯甲醇催化氧化可得到苯甲醛,则合成路线为:
,再结合苯甲醇催化氧化可得到苯甲醛,则合成路线为:
![]()
![]()
![]()

![]()

![]()
 。
。


 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】实验室里从海藻中提取碘的流程如下图:
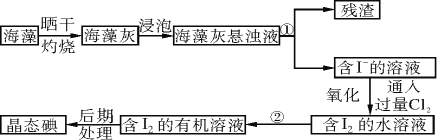
(1)指出制取碘的过程中有关的实验操作名称(或仪器):
①操作名称________________,②仪器________________。
(2)提取碘的过程中,可供选择的有机溶剂是________(填字母序号)。
a.甲苯、酒精 b.四氯化碳、苯
c.汽油、乙酸 d.汽油、甘油
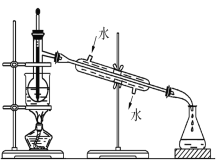
(3)含碘的有机物溶液中提取碘和回收有机溶剂,还需要经过蒸馏,观察下列实验装置指出其错误之处,并指出正确操作。____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.14g聚丙烯中含C-H键总数目为2NA
B.常温下,pH=13的NaOH溶液中含有的OH-数目为0.1NA
C.100mL12mol·L-1浓硝酸与过量Cu反应转移电子的数目为0.6NA
D.电解精炼铜时,若阳极质量减少64g,则阴极得到电子的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g) ![]() 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法不正确的是
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法不正确的是
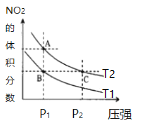
A.A点的反应速率小于C点的反应速率
B.A、C两点气体的颜色:A浅,C深
C.由状态B到状态A,可以用降温的方法
D.A、C两点气体的平均相对分子质量:A<C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生产生活中应用广泛。回答下列问题:
(1)“中国制造2025”是中国政府实施制造强国战略第一个十年行动纲领。氮化铬(CrN)具有极高的硬度和力学强度、优异的抗腐蚀性能和高温稳定性能,氮化铬在现代工业中发挥更重要的作用,请写出Cr3+的外围电子排布式____;基态铬、氮原子的核外未成对电子数之比为____。
(2)氮化铬的晶体结构类型与氯化钠相同,但氮化铬熔点(1282℃)比氯化钠 (801'C)的高,主要原因是________。
(3)过硫酸铵[(NH4)2S2O8],广泛地用于蓄电池工业、石油开采、淀粉加工、油脂工业、照相工业等,过硫酸铵中N、S、O的第一电离能由大到小的顺序为 _______,其中NH4+的空间构型为____________
(4)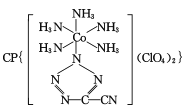 是20世纪80年代美国研制的典型钝感起爆药Ⅲ,它是由
是20世纪80年代美国研制的典型钝感起爆药Ⅲ,它是由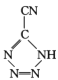 和[Co(NH3)5H2O](ClO4)3反应合成的,
和[Co(NH3)5H2O](ClO4)3反应合成的,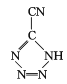 中孤电子对与π键比值为 _______, CP的中心Co3+的配位数为 ______ 。
中孤电子对与π键比值为 _______, CP的中心Co3+的配位数为 ______ 。
(5)铁氮化合物是磁性材料研究中的热点课题之一,因其具有高饱和磁化强度、低矫顽力,有望获得较高的微波磁导率,具有极大的市场潜力,其四子格结构如图所示,已知晶体密度为ρgcm-3,阿伏加德罗常数为NA。
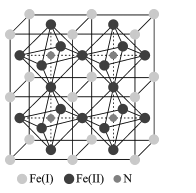
①写出氮化铁中铁的堆积方式为____。
②该化合物的化学式为 ___。
③计算出 Fe(II)围成的八面体的体积为____cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研人员以废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO)为原料回收镍,工艺流程如下:

已知:常温下,有关氢氧化物开始沉淀和沉淀完全的pH如表:

回答下列问题:
(1)浸出渣主要成分为_________(填化学式)。
(2)“除铜”时,Fe3+与H2S反应的离子方程式为__________________。
(3)“氧化”的目的是将溶液中Fe2+氧化为Fe3+,温度需控制在40~50℃之间,该步骤温度不能太高的原因是_______________________。
(4)“调pH”时,pH的控制范围为_________。
(5)在碱性条件下,电解产生2NiOOH·H2O的原理分两步,其中第一步是Cl-在阳极被氧化为ClO-,则该电极反应式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列中心原子的杂化轨道类型和分子几何构型不正确的是
A. CCl4中C原子sp3杂化,为正四面体形
B. H2S分子中,S为sp2杂化,为直线形
C. CS2中C原子sp杂化,为直线形
D. BF3中B原子sp2杂化,为平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=![]() mol/L
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com