
【题目】周期表前四周期的元素X、Y、Z、W,原子序数依次增大,X原子核外有6种不同运动状态的电子;Y原子基态时2p原子轨道上有3个未成对的电子;Z有多种氧化物,其中一种红棕色氧化物可作涂料;W位于第四周期,其原子最外层只有1个电子,且内层都处于全充满状态。回答下列问题:
(1)X位于周期表的第__________________周期,第__________________族。
(2)元素的第一电离能:X__________________Y(填“>”或“<”,下同);原子半径:X__________________Y。
(3)Y的最高价氧化物对应水化物中酸根离子的空间构型__________________(用文字描述)。
(4)Z3+基态核外电子排布式为__________________,用硫氰化钾溶液检验Z3+的离子方程式为__________________。
【答案】二 IVA < > 平面三角形 1s22s22p63s23p63d5或[Ar]3d5 Fe3++3SCN-=Fe(SCN)3
【解析】
周期表前四周期的元素X、Y、Z、W,原子序数依次增大,X原子核外有6种不同运动状态的电子,X为C元素;Y原子基态时2p原子轨道上有3个未成对的电子,Y为N元素;Z有多种氧化物,其中一种红棕色氧化物可作涂料,涂料的为Fe2O3,Z为Fe元素;W位于第四周期,其原子最外层只有1个电子,且内层都处于全充满状态1s22s22p63s23p63d104s1,即为Cu元素;所以前四周期的元素 X、Y、Z、W分别为:C、N、Fe、Cu。
(1)X为碳元素,位于周期表的第二周期第ⅣA族;故答案为:二;ⅣA;
(2)同一周期元素的第一电离能随原子序数的增大而增大,但第ⅡA大于ⅢA,第ⅤA大于ⅥA,所以C小于N元素的第一电离能;同周期原子半径从左向右逐渐减小,所以原子半径:C>N;故答案为:<;>;
(3)根据价层电子对数推出空间结构,N的最高价氧化物对应水化物中酸根离子即NO3-的空间构型:3+![]() =3,价层电子对数为3,孤电子对数为0,所以是平面三角形;故答案为:平面三角形;
=3,价层电子对数为3,孤电子对数为0,所以是平面三角形;故答案为:平面三角形;
(4)Fe基态核外电子排布式为:1s22s22p63s23p63d64s2或[Ar]3d64s2;失去3个电子后,得出Fe3+的电子排布式为:1s22s22p63s23p63d5或[Ar]3d5;用硫氰化钾溶液检验Z3+生成血红色的络合物,离子方程式为Fe3++3SCN-=Fe(SCN)3;故答案为:1s22s22p63s23p63d5或[Ar]3d5;Fe3++3SCN-=Fe(SCN)3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质互为同分异构体的是( )
A. CH3—CH3和CH3—CH2—CH3
B. 12C和14C
C. CH3—CH2—CH2—CH3和(CH3)2CHCH3
D. 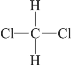 和
和 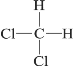
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫。有人设计下列实验以确认反应混合气体中含有乙烯和二氧化硫,装置如图所示,试回答下列问题。

(1)图中①②③④装置可盛放的试剂分别是___________________(填序号,下同)、___________________、___________________、___________________。
A.品红溶液 B.![]() 溶液 C.浓硫酸 D.酸性
溶液 C.浓硫酸 D.酸性![]() 溶液
溶液
(2)能说明二氧化硫气体存在的现象是______________________________________。
(3)使用装置②的目的是________________________,使用装置③的目的是________________________。
(4)能说明混合气体中含有乙烯的现象是____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用AG表示溶液的酸度(acidity grade),AG的定义为AG = lg[![]() ].室温下实验室中用0.01molL-1的氢氧化钠溶液滴定20.00mL 0.01molL-1的一元弱酸HA,滴定过程如图所示,下列叙述正确的是( )
].室温下实验室中用0.01molL-1的氢氧化钠溶液滴定20.00mL 0.01molL-1的一元弱酸HA,滴定过程如图所示,下列叙述正确的是( )

A. 室温下,弱酸HA的电离常数约为10-5
B. A点时加入氢氧化钠溶液的体积为20.00mL
C. 若B点为40mL,所得溶液中:c(OH-) = c(A-)+c(HA)+c(H+)
D. 反应过程中一定存在:0.01molL-1+c(OH-)=c(Na+)+c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测正确的是( )
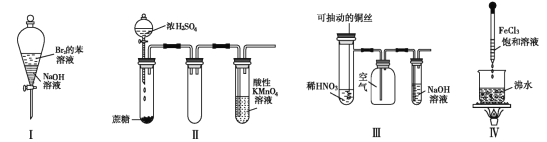
A. 实验Ⅰ:振荡后静置,上层溶液颜色保持不变
B. 实验Ⅱ :酸性 KMnO4 溶液中出现气泡,且颜色逐渐褪去
C. 实验Ⅲ:微热稀 HNO3 片刻,溶液中有气泡产生,广口瓶内始终保持无色
D. 实验Ⅳ:滴入 FeCl3 后,可形成带电的胶体,该分散系导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍的抗腐蚀性佳,主要用于合金和电镀,也可用作良好的催化剂。现准确称量8g粗镍(含有少量Fe、Cu以及难与酸、碱反应的杂质)进行如下提纯。
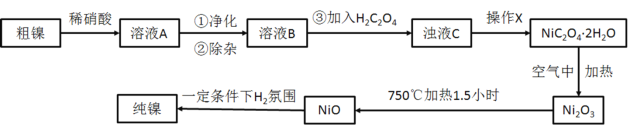
请回答下列问题:
(1)写出稀硝酸溶解镍的离子方程式___。
(2)在溶液A的净化除杂中,首先将溶液A煮沸,调节pH=5.5,继续加热煮沸5min,加热过程中补充适量的水保持溶液的体积不变,静止一段时间后,过滤出Fe2O3、FeO(OH)。
①写出煮沸过程中生成FeO(OH)的离子方程式___。
②控制溶液的pH,可利用___。
a.pH试纸 b.石蕊指示剂 c.pH计
③为了得到纯净的溶液B,还需要加入以下物质___(填字母)进行除杂。(已知:Ksp(CuS)=8.8×10-36;Ksp(NiS)=3.2×10-19;Ksp[Cu(OH)2]=2.2×10-20;Ksp[Ni(OH)2]=5.4×10-16)
a.NaOH b.Na2S C.H2S d.NH3·H2O
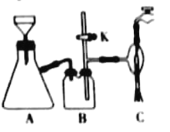
(3)在快速搅拌下缓慢向溶液B中滴加12%的H2C2O4溶液,溶液中即可析出NiC2O4·2H2O,搅拌下煮沸2min冷却。操作X包括:过滤、洗涤和烘干,采用如图的装置进行过滤(备注:该图是一个通过水泵减压过滤的装置)。这种抽滤其优点是___,装置B的主要作用是___,若实验过程中发现倒吸现象,应采取的措施是___。
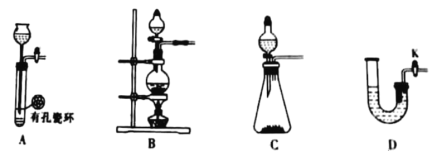
(4)在该生产过程中需要纯净的H2。若实验室要制备纯净的H2,发生装置不可以选择___(选填代号)。
(5)用电子天平称取0.5000g的NiO样品,加入一定体积的6mol/L的盐酸恰好完全溶解,将所得到的溶液配制成250mL的溶液。取出20mL加入锥形瓶,按照如下滴定原理进行沉淀滴定,最终得到干燥的固体mg,则镍元素的质量分数为___。(写出表达式即可)
[一定条件下丁二酮肟(![]() ,简写为C4N2H8O2)能和Ni2+反应生产鲜红色的沉淀,其方程式为:Ni2++2C4N2H8O2+2NH3·H2O=Ni(C4N2H7O2)2↓+2NH4++2H2O,Ni(C4N2H7O2)2的摩尔质量为289g/mol]。Ni2+能与CO32-、C2O42-、S2-等离子形成沉淀,但为什么很多情况下选用丁二酮肟有机沉淀剂?___。
,简写为C4N2H8O2)能和Ni2+反应生产鲜红色的沉淀,其方程式为:Ni2++2C4N2H8O2+2NH3·H2O=Ni(C4N2H7O2)2↓+2NH4++2H2O,Ni(C4N2H7O2)2的摩尔质量为289g/mol]。Ni2+能与CO32-、C2O42-、S2-等离子形成沉淀,但为什么很多情况下选用丁二酮肟有机沉淀剂?___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯净干燥的氯气与熔融金属锡反应可制备 SnCl4,某化学小组的同学设计了如下实验装置进行制备。

已知:①金属锡熔点为 231℃,化学活泼性与铁相似;②SnCl4 的沸点为 114℃;③SnCl4 易与水反应。
请根据上图装置回答:
(1)装置Ⅳ中发生反应的化学方程式为__________________________。
(2)试管II中的试剂是___________________,装置 V 的作用是______________。
(3)裝置Ⅵ最好选用下列装置中的______________________(填标号)。

(4)实验结束后,欲回收利用装置Ⅰ中未反应完的 MnO2,需要的分离方法___________。
(5)为了顺利完成实验,点燃酒精灯的正确操作是___________________(填字母)。
A.先点燃 I 处酒精灯,后点燃Ⅳ处酒精灯
B.先点燃Ⅳ处酒精灯,后点燃 I 处酒精灯
C.同时点燃 I、Ⅳ两处酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中的两个量,其比值一定为2∶1的是 ( )
A.在反应2FeCl3+Fe =3FeCl2中还原产物与氧化产物的质量
B.相同温度下,0.2 mol·L-1CH3COOH溶液与0.1 mol·L-1CH3COOH溶液中c(H+)
C.在密闭容器中,N2+3H2![]() 2NH3已达平衡时c(NH3)与c(N2)
2NH3已达平衡时c(NH3)与c(N2)
D.液面均在“0”刻度时,50 mL碱式滴定管和25 mL碱式滴定管所盛溶液的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com