
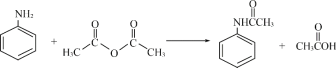
【题目】酰苯胺作为一种常用药,具有解热镇痛的效果。实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率,现选用苯胺与乙酸酐为原料制取和提纯乙酰苯胺,该放热反应的原理:
密度(g/mL) | 相对分子质量 | 颜色、状态 | 溶解性 | |
苯胺 | 1.04 | 93 | 无色油状液体 | 微溶于水, 易溶于乙醇、乙醚 |
乙酸酐 | 1.08 | 102 | 无色透明液体 | 遇水缓慢反应生成乙酸 |
乙酰苯胺 | 135 | 无色片状晶体, 熔点 114℃ | 不溶于冷水,可溶于热 水、乙醇、乙醚 |
实验步骤
①取 5.00mL 苯胺,倒入 100mL 锥形瓶中,加入 20mL 水,在旋摇下分批加入 6.00mL 乙酸酐,搅拌均匀。若有结块现象产生,用玻璃棒将块状物研碎,再充分搅拌;
②反应完全后,及时把反应混合物转移到烧杯中,冷却后,抽滤,洗涤,得粗乙酰苯胺固体;
③将粗产品转移至 150mL 烧杯中,加入适量水配制成 80℃的饱和溶液,再加入过量 20%的水。稍冷后,加半匙活性炭,搅拌下将溶液煮沸 3~5min,趁热过滤,冷却结晶,抽滤、洗涤、晾干得乙酰苯胺纯品。
请回答:
(1)苯胺与冰醋酸反应制备乙酰苯胺的化学反应方程式____________________________________。
(2)反应温度过高会导致苯胺挥发,下列操作可控制反应温度,防止反应温度升高过快的是____________。
A.反应快结束时的充分搅拌 B.旋摇下分批加入 6.0mL 乙酸酐
C.玻璃棒将块状物研碎 D.加 20mL 水
(3)在步骤②中对粗产品进行洗涤可能需要用到以下操作:a.加入洗涤剂至浸没固体;b. 洗涤剂缓慢通过;c.洗涤剂快速通过;d.关小水龙头;e.开大水龙头;f.重复 2~3 次。请选出正确的操作并排序_____。(操作可重复使用)
(4)加入过量 20%的水的目的是_____。
(5)下列关于步骤③说法不正确的是__________________________。
A. 活性炭吸附有色物质,可以提高产率
B. 冷却时,冰水浴冷却比室温冷却更易得到大颗粒晶体便于抽滤
C. 抽滤用如图装置,为防止倒吸,结束时可先关闭抽气泵,后打开活塞 a
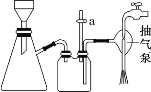
D. 洗涤完成后应将布氏漏斗从吸滤瓶上取下,左手握布氏漏斗,倒转,用右手“拍击”左手, 使固体连同滤纸一起落入洁净的表面皿上,揭去滤纸,再对固体做晾干处理
(6)最后测得纯乙酰苯胺固体 5.40g,该实验的产率为_____(保留三位有效数字)。
【答案】![]() BD dabef 防止加热煮沸时,溶剂减少使产品析出导致产率降低 ABC 71.5%或 0.715
BD dabef 防止加热煮沸时,溶剂减少使产品析出导致产率降低 ABC 71.5%或 0.715
【解析】
(1)苯胺与冰醋酸反应制备乙酰苯胺的化学反应方程式
![]()
答案为:![]()
(2)A.反应快结束时的充分搅拌,溶液温度已经快速升高,不合题意;
B.旋摇下分批加入6.0mL乙酸酐,反应物浓度小,反应速率慢,符合题意;
C.玻璃棒将块状物研碎,增大接触面积,加快反应速率,不合题意;
D.加 20mL 水,降低浓度,反应班级慢,符合题意。
故选BD。
(3)正确的操作并排序dabef。
答案为:dabef
(4)加入过量 20%的水的目的是防止加热煮沸时,溶剂减少使产品析出导致产率降低。
答案为:防止加热煮沸时,溶剂减少使产品析出导致产率降低
(5)A. 活性炭吸附有色物质,对反应没有影响,不能提高产率,错误;
B. 冷却时,冰水浴冷却,温度下降快,晶体结晶快,晶体颗粒小,不便于抽滤,错误;
C. 抽滤用如图装置,为防止倒吸,结束时可先打开活塞 a,后关闭抽气泵,错误;
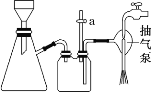
D. 洗涤完成后应将布氏漏斗从吸滤瓶上取下,左手握布氏漏斗,倒转,用右手“拍击”左手, 使固体连同滤纸一起落入洁净的表面皿上,揭去滤纸,再对固体做晾干处理,正确。
故选ABC
(6)![]()
![]()
因为苯胺与乙酸酐等摩反应,所以苯胺过量,应使用乙酸酐进行计算。
![]()
最后测得纯乙酰苯胺固体 5.40g,该实验的产率为
![]()
答案为:71.5%或 0.715


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 在鸡蛋清溶液中分别加入饱和![]() 溶液,都会因盐析产生沉淀
溶液,都会因盐析产生沉淀
B. 油脂为高分子化合物,其饱和程度越大,熔点越低
C. ![]() 的水解产物是
的水解产物是![]() 和
和![]()
D. 麦芽糖及其水解产物均能与新制氢氧化铜悬浊液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量通常用来衡量一个国家的石油化工水平,某化学实验小组为了探究石蜡油(17个碳以上的液态烷烃混合物)分解产物中有乙烯存在,设计了如下实验方案:
(查阅资料可知:乙烯与酸性高锰酸钾溶液反应产生二氧化碳。)
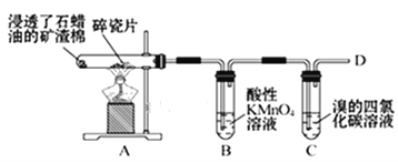
(1)乙烯的结构式是___。
(2)B中实验现象:___。
(3)C中发生反应的化学方程式:__,反应类型:___。
(4)通过上述实验探究可知,除去乙烷中混有的乙烯,可以选择的试剂是___。
A.水 B.溴水
C.氢氧化钠溶液 D.酸性高锰酸钾溶液
(5)关于乙烯,下列说法中不正确的是___。
A.聚乙烯塑料可以用做食品包装袋
B.乙烯在一定条件下可以和水反应制乙醇
C.乙烯分子中所有原子不共面
D.乙烯是一种植物生长调节剂,可以延长果实和花朵的成熟期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产生活中广泛存在。请回答:
(1)催化转化器可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应, 生成无毒物质,减少汽车尾气污染。
已知:
N2(g)+O2(g)=2NO(g) △H1=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H2= -221.0 kJ·mol-1
C(s)+O2(g)=CO2(g) △H3= -393.5 kJ·mol-1
计算尾气转化反应 2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=_____。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应的热化学方程式为:4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(g) △H= -11.63 kJ·mol-1。反应在2L 密闭容器中进行,在其它条件相同时,使用不同的催化剂 A、B、C,产生 N2 的物质的量随时间变化如图 1 所示。
5N2(g)+6H2O(g) △H= -11.63 kJ·mol-1。反应在2L 密闭容器中进行,在其它条件相同时,使用不同的催化剂 A、B、C,产生 N2 的物质的量随时间变化如图 1 所示。

图1 图2
①下列有关说法正确的是__________________________________。
A. 反应在任何温度下均可自发进行
B. 50 s 在催化剂A 作用下,平均反应速率v(N2)=2.5×10-2mol·L-1·s-1
C. 用催化剂C 达到平衡时,N2 产率最小
D. 分离出反应体系中的H2O(g)有利于氮氧化物的脱除
E. 相同条件下,若使用催化剂 B,使逆反应速率加快 100 倍,使用催化剂 C,使正反应速率加快 65 倍,则应该选用催化剂 B
②在催化剂A 的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如图 2 所示,据图可知,在相同的时间内,300℃之前,温度升高脱氮率逐渐增大,300℃之后温度升高脱氮率逐渐减小(假设催化剂活性不受影响),写出脱氮率随温度变化的原因__________________________。
③其他条件相同时,请在图 2 中补充在催化剂B 作用下脱氮率随温度变化的曲线。__________________________________________________________
(3)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的 NO,装置如图所示
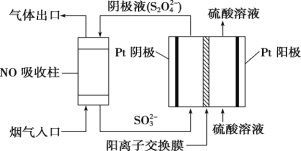
① 阴极区的电极反应式为___________________________________________ 。
② 通电时,当电路中转移 0.2mol e-,可吸收的 NO 在标准状况下的体积为 896mL。则 NO转化后的产物为_____________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C![]() 2AlN+3CO.下列叙述正确的是( )
2AlN+3CO.下列叙述正确的是( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2 mol AlN,N2得到3 mol电子
C.氮化铝中氮元素的化合价为﹣3
D.氮化铝晶体属于分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是( )

A. 铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
B. 如果将锌片换成铁片,电路中的电流方向将改变
C. 其能量转化的形式主要是“化学能→电能→光能”
D. 如果将稀硫酸换成柠檬汁,LED灯将不会发光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扁桃酸衍生物是重要的医药中间体,以A和B 为原料合成扁桃酸衍生物F路线如下:
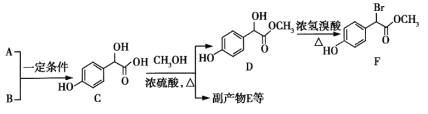
(1)A的分子式为C2H2O3,可发生银镜反应,且具有酸性,A所含官能团名称为:_________。写出A+B→C的化学反应方程式__________________________。
(2)C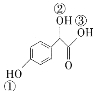 中①、②、③3个—OH的酸性由强到弱的顺序是:_______。
中①、②、③3个—OH的酸性由强到弱的顺序是:_______。
(3)E是由2分子C生成的含有3个六元环的化合物,E的分子中不同化学环境的氢原子有_____种。
(4)D→F的反应类型是______,1mol F在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为_______mol。写出符合下列条件的F的所有同分异构体(不考虑立体异构)的结构简式____。
①属于一元酸类化合物 ②苯环上只有2个取代基且处于对位,其中一个是羟基
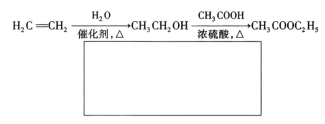
(5)已知:![]() 。A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)合成路线流程图示例如下:
。A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)合成路线流程图示例如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系正确的是
A. 沸点:新戊烷>2,2-二甲基戊烷>丙烷
B. 密度:CCl4>H2O>甲苯
C. 等质量的物质燃烧耗O2量:乙烷>乙烯>乙炔>甲烷
D. 等物质的量物质燃烧耗O2量:环己烷>苯>苯甲醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com