
| A、v(R)=0.1mol?L-1?min-1 |
| B、v(P)=0.3mol?L-1?min-1 |
| C、v(Q)=0.3mol?L-1?min-1 |
| D、v(Q)=0.6mol?L-1?min-1 |
| 3 |
| 2 |
| 3 |
| 2 |


科目:高中化学 来源: 题型:
| c(NO)?c(SO3) |
| c(NO2)?c(SO2) |
| A、该反应的焓变为正值 |
| B、恒温下减小压强,反应体系的颜色加深 |
| C、升高温度,逆反应速率减小 |
| D、该反应化学方程式为NO2+SO?NO+SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、改变外界条件不能改变化学平衡状态 |
| B、当某反应在一定条件下反应物转化率保持不变时即达到了化学平衡状态 |
| C、当某反应体系中气体的压强不再改变时,该反应一定达到平衡状态 |
| D、当某反应达到平衡状态时,反应物和生成物的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaClO溶液中通入少量的SO2气体:2ClO-+SO2+H2O═SO32-+2HClO | ||||
| B、往氨水中滴加FeCl3溶液:Fe3++3OH-═Fe(OH)3↓ | ||||
| C、向Ca(HCO3)2溶液中滴加过量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | ||||
D、等体积等物质的量浓度的NH4HCO3与Ba(OH)2溶液混合后加热:NH4++OH-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Li是负极,电极反应为Li-e-=Li+ |
| B、Li是正极,电极反应为Li+e-=Li- |
| C、MnO2是负极,电极反应为MnO2+e-=MnO2- |
| D、锂电池工作过程:化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu片、Cu片 |
| B、Cu片、Al片 |
| C、Al片、Al片 |
| D、Al片、Cu片 |
查看答案和解析>>
科目:高中化学 来源: 题型:
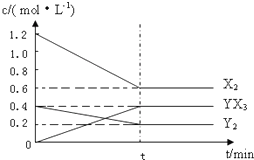 已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素.
已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素.查看答案和解析>>
科目:高中化学 来源: 题型:
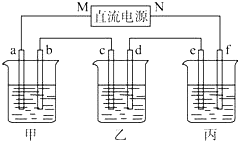 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放NaCl溶液、足量的AgNO3溶液和 K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放NaCl溶液、足量的AgNO3溶液和 K2SO4溶液,电极均为石墨电极.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com