
| A、Li是负极,电极反应为Li-e-=Li+ |
| B、Li是正极,电极反应为Li+e-=Li- |
| C、MnO2是负极,电极反应为MnO2+e-=MnO2- |
| D、锂电池工作过程:化学能转化为电能 |


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
| A、Cu(OH)2与盐酸:Cu2++2OH-+2H+=Cu2++2H2O |
| B、Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| C、MgCl2溶液中滴加氨水:Mg2++2OH-=Mg(OH)2↓ |
| D、BaCO3与盐酸:CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是氢氧燃料电池构造示意图,电解质用的是30%的KOH溶液.关于该电池的说法不正确的是( )
如图是氢氧燃料电池构造示意图,电解质用的是30%的KOH溶液.关于该电池的说法不正确的是( )| A、a极是负极 |
| B、电子由b通过灯泡流向a |
| C、氢氧燃料电池是环保电池 |
| D、正极的电极反应是:O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(R)=0.1mol?L-1?min-1 |
| B、v(P)=0.3mol?L-1?min-1 |
| C、v(Q)=0.3mol?L-1?min-1 |
| D、v(Q)=0.6mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增加A的量,平衡向正反应方向移动 |
| B、升高温度,平衡向逆反应方向移动,v(正)增大 |
| C、压强增大一倍,平衡不移动,v(正)、v(逆)增大 |
| D、加入催化剂,B的转化率提高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
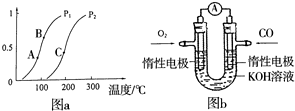 开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com