
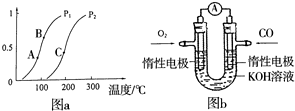
 ������ʹ�������Դ��չ����̼���á�������Ϊ��ѧ���о�����Ҫ���⣮�������״������ʵ����ȼ�ϣ�������ȼ�ϵ�أ�
������ʹ�������Դ��չ����̼���á�������Ϊ��ѧ���о�����Ҫ���⣮�������״������ʵ����ȼ�ϣ�������ȼ�ϵ�أ�| m |
| V |
| 0.0153��0.005 |
| 0.005��0.015 |
| ||
| 0.02mol |
| 0.2L |


 ��ս100��Ԫ����Ծ�ϵ�д�
��ս100��Ԫ����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������Ԫ�صĻ����һ������ǿ������ |
| B��������ֻ�������ԣ�������ֻ�л�ԭ�� |
| C��ʧ����Խ�࣬��ԭ��Խǿ |
| D������������ԭ��Ӧ�Ļ��Ϸ�Ӧ��һ������Ϊ�е��ʲ����˷�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ı�����������ܸı仯ѧƽ��״̬ |
| B����ij��Ӧ��һ�������·�Ӧ��ת���ʱ��ֲ���ʱ���ﵽ�˻�ѧƽ��״̬ |
| C����ij��Ӧ��ϵ�������ѹǿ���ٸı�ʱ���÷�Ӧһ���ﵽƽ��״̬ |
| D����ij��Ӧ�ﵽƽ��״̬ʱ����Ӧ����������Ũ��һ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Li�Ǹ������缫��ӦΪLi-e-=Li+ |
| B��Li���������缫��ӦΪLi+e-=Li- |
| C��MnO2�Ǹ������缫��ӦΪMnO2+e-=MnO2- |
| D��﮵�ع������̣���ѧ��ת��Ϊ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CuƬ��CuƬ |
| B��CuƬ��AlƬ |
| C��AlƬ��AlƬ |
| D��AlƬ��CuƬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
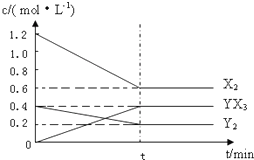 ��֪����������Ԫ��X��Y��Z��W��ԭ����������������X��Y��ԭ������֮�͵���Z��ԭ��������X��Z���γ�X2Z��X2Z2���ֻ����W�Ƕ���������Ԫ���а뾶����Ԫ�أ�
��֪����������Ԫ��X��Y��Z��W��ԭ����������������X��Y��ԭ������֮�͵���Z��ԭ��������X��Z���γ�X2Z��X2Z2���ֻ����W�Ƕ���������Ԫ���а뾶����Ԫ�أ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com