
【题目】(一)实验室利用如图装置进行中和热的测定。回答下列问题:
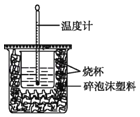
(1)该图中有一处未画出,它是_____(填仪器名称)。
(2)如果用0.50 mol/L的盐酸和氢氧化钠固体进行实验,则根据此实验的数据书写中和热的热化学方程式中的△H将_____(填“偏大”“偏小”或“不变”),原因是_____。
(3)利用50 mL 0.50 mol/L的稀盐酸与50 mL 0.55 mol/L的稀氢氧化钠溶液进行实验,设溶液的密度均为1 g/cm3,中和后溶液的比热容c=4.18 J/(g℃),请根据实验数据计算,中和热△H=_____ (取小数点后一位)。
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
盐酸 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.4 |
2 | 27.0 | 27.4 | 27.2 | 31.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
(4)上述(3)中的结果与中和热的理论值有偏差,产生偏差的原因可能是_____
a.实验装置保温、隔热效果差
b.使用环形玻璃搅拌棒搅拌,使其充分反应
c.分多次把NaOH溶液倒入盛有稀盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度
(二)某学生用0.2000molL﹣1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固体好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号)_____,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)_____。
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无影响”)_____。
(3)判断滴定终点的现象是:_____。
(4)如图是某次滴定时的滴定管中的液面,其读数为_____mL。

(5)根据下列数据:请计算待测盐酸溶液的浓度:_____。
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.30 | 20.40 |
第二次 | 20.00 | 4.00 | 24.20 |
第三次 | 20.00 | 2.00 | 24.30 |
【答案】环形玻璃搅拌棒 偏小 NaOH固体溶解放热,中和热的△H为负值 -55.2kJ/mol acd ① 偏大 偏小 当滴入最后一滴氢氧化钠溶液,溶液由无色变为粉红色,且半分钟内不褪色 22.60 0.2150mol/L
【解析】
(一)(1)根据量热计的构造判断该装置缺少仪器;
(2)NaOH固体溶于水放热,使反应热偏大,结合中和热的热化学方程式中的△H为负值分析解答;
(3)先判断温度差的有效性,然后求出温度差平均值,再根据Q=mc△T计算反应放出的热量,然后根据△H=-![]() kJ/mol计算出反应热;
kJ/mol计算出反应热;
(4)上述(3)中的中和热比中和热的理论值小。根据实验操作对放出的热量的影响分析判断;
(二)(1)碱式滴定管在装液前没有用所装液体进行润洗;没有用标准液润洗,导致标准液浓度减小,滴定过程中消耗标准液体积偏大;
(2)滴定终点时,滴定管尖嘴有气泡,导致消耗消耗标准液体积偏小;
(3)根据溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(4)滴定管的最小读数为0.01mL,滴定管0刻度在上方,结合图示液面判断溶液体积;
(5)先根据数据的有效性,舍去第3组数据,然后求出1、2组平均消耗V(NaOH),接着根据c(待测)=![]() 计算。
计算。
(一)(1)根据量热计的构造可知,该装置的缺少的仪器是环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
(2)NaOH固体溶于水放热,使反应放出的热量偏多,但中和热的△H为负值,所以反应热偏大,△H偏小,故答案为:偏小;NaOH固体溶解放热,中和热的△H为负值;
(3)3次温度差分别为:3.3℃,4.1℃,3.3℃,第2组数据偏差较大,舍去,温度差平均值为3.3℃,50mL0.50mol/L稀盐酸与50mL0.55mol/L氢氧化钠溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:100mL×1g/mL=110g,温度变化的值为△T=3.3℃,则生成0.025mol水放出的热量为Q=mc△T=100g×4.18J/(g℃)×3.3℃=1.3794kJ,所以实验测得的中和热△H=-![]() =-55.2kJ/mol,故答案为:-55.2kJ/mol;
=-55.2kJ/mol,故答案为:-55.2kJ/mol;
(4)上述(3)中的中和热比中和热的理论值小。a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a选;b.使用环形玻璃搅拌棒搅拌,使其充分反应,不会对结果产生影响,故b不选;c.分多次把NaOH溶液倒入盛有稀盐酸的小烧杯中,会导致热量损失大,温度差小,中和热的数值偏低,故c选;d.温度计测定NaOH溶液起始温度后直接插入稀盐酸测温度,盐酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d选;故答案为:acd。
(二)(1)碱式滴定管在装液前应用所装液体进行润洗,用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上,碱式滴定管未用标准氢氧化钠溶液润洗,就直接注入标准NaOH溶液,导致标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=![]() 可知,c(标准)偏大,故答案为:①;偏大;
可知,c(标准)偏大,故答案为:①;偏大;
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,造成V(标准)读数偏小,根据c(待测)=![]() 可知,c(待测)偏小,故答案为:偏小;
可知,c(待测)偏小,故答案为:偏小;
(3)滴定时,当溶液颜色变化且半分钟内不变色,可说明达到滴定终点,所以当滴入最后一滴氢氧化钠溶液,溶液由无色变为粉红色,且半分钟内不褪色,说明达到滴定终点,故答案为:当滴入最后一滴氢氧化钠溶液,溶液由无色变为粉红色,且半分钟内不褪色;
(4)根据图示可知,滴定管中的液面读数为22.60mL,故答案为:22.60;
(5)三次滴定消耗的体积为:20.10mL,20.20mL,22.30,舍去第3组数据,1、2组平均消耗V(NaOH)=![]() =20.15mL,c(待测)=
=20.15mL,c(待测)=![]() =0.2150molL-1,故答案为:0.2150mol/L。
=0.2150molL-1,故答案为:0.2150mol/L。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】有一瓶无色澄清的溶液,其中可能含NH4+、K+、Na+、Mg2+、H+、Cu2+、CO32-、I-中的一种或几种,取该溶液进行如下实验:
①用pH试纸检验,发现溶液呈强酸性。
②取部分溶液,逐滴加入NaOH稀溶液,使溶液逐渐从酸性转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成。
③将②得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实回答下列问题:
(1)在溶液中,肯定存在的离子有________,肯定不存在的离子有________,不能确定是否存在的离子有________。
(2)写出实验③中的离子方程式:___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是![]()
![]()
A.常温下,![]() 的甲酸溶液的
的甲酸溶液的![]() 与
与![]() 的氨水溶液中由水电离产生的
的氨水溶液中由水电离产生的![]() 相等
相等
B.中和 ![]() 醋酸与中和
醋酸与中和 ![]() 的醋酸所需同种碱溶液的物质的量不同
的醋酸所需同种碱溶液的物质的量不同
C.向![]() 溶液中逐渐加入适量NaOH固体,溶液的导电性明显增强
溶液中逐渐加入适量NaOH固体,溶液的导电性明显增强
D.向饱和石灰水中加入少量CaO,恢复至室温后溶液中![]() 增大,导电能力增强
增大,导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )

A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,其结构如图,对杀伤肿瘤细胞有独特作用。下列有关汉黄芩素的叙述不正确的是

A. 该物质属于芳香族化合物 B. 汉黄芩素的分子式为C16H13O5
C. 1mol该物质与氢氧化钠溶液反应,最多消耗2molNaOH D. 与足量H2发生加成反应后,该分子中官能团的种类减少2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质互为同分异构体的是( )
A. CH3—CH3和CH3—CH2—CH3
B. 12C和14C
C. CH3—CH2—CH2—CH3和(CH3)2CHCH3
D. 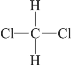 和
和 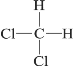
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据要求回答下列问题:
①干冰与CO2;②白磷与红磷;③![]() Cl与
Cl与![]() Cl;④液氯与氯水;⑤
Cl;④液氯与氯水;⑤![]() 与
与 。在上述各组物质中:
。在上述各组物质中:
互为同位素的是__________________;
互为同素异形体的是__________________;
互为同分异构体的是__________________;
属于同种物质的是__________________。(填序号,下同)
(2)现有以下六种物质形成的晶体:a.NH4Cl;b.SiO2;c.Na2O2;d.干冰;e.C60;f.Ne请用相应字母填空:
属于分子晶体的是__________________;属于共价化合物的是__________________;属于离子化合物的是___________;熔化时只需要破坏共价键的是__________________;既含有离子键又含有非极性共价键的是__________________;不存在化学键的是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用AG表示溶液的酸度(acidity grade),AG的定义为AG = lg[![]() ].室温下实验室中用0.01molL-1的氢氧化钠溶液滴定20.00mL 0.01molL-1的一元弱酸HA,滴定过程如图所示,下列叙述正确的是( )
].室温下实验室中用0.01molL-1的氢氧化钠溶液滴定20.00mL 0.01molL-1的一元弱酸HA,滴定过程如图所示,下列叙述正确的是( )

A. 室温下,弱酸HA的电离常数约为10-5
B. A点时加入氢氧化钠溶液的体积为20.00mL
C. 若B点为40mL,所得溶液中:c(OH-) = c(A-)+c(HA)+c(H+)
D. 反应过程中一定存在:0.01molL-1+c(OH-)=c(Na+)+c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,发生反应:![]() 。当下列所给有关量不再变化时,不能表明该反应已达平衡状态的是
。当下列所给有关量不再变化时,不能表明该反应已达平衡状态的是![]()
![]()
A.混合气体的压强B.混合气体的密度
C.混合气体的平均相对分子质量D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com