
【题目】请完成下列问题:
(1)画出氯原子结构示意图________;
(2)写出小苏打的化学式________;
(3)写出实验室制氯气的离子方程式________;
(4)写出红热的木炭与浓硫酸反应的化学方程式________。
【答案】 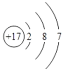 NaHCO3 MnO2+2Cl﹣+4H+
NaHCO3 MnO2+2Cl﹣+4H+![]() Mn2++Cl2↑+2H2O C+2H2SO4(浓)
Mn2++Cl2↑+2H2O C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
【解析】
(1)氯原子的核内有17个质子,核外有17个电子;
(2)碳酸氢钠俗称小苏打;
(3)实验室用二氧化锰和浓盐酸加热制取氯气;
(4)木炭在加热条件下被浓硫酸氧化为二氧化碳,浓硫酸被还原为二氧化硫,据此分析。
(1)氯原子的核内有17个质子,带17个正电荷,核外有17个电子,故原子结构示意图为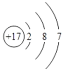 ;
;
(2)碳酸氢钠俗称小苏打,化学式为NaHCO3;
(3)实验室用二氧化锰和浓盐酸加热制取氯气,二氧化锰将浓盐酸氧化为氯气,二氧化锰被还原为氯化锰,同时有水生成,故化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,离子方程式为MnO2+2Cl﹣+4H+
MnCl2+Cl2↑+2H2O,离子方程式为MnO2+2Cl﹣+4H+![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(4)木炭在加热条件下被浓硫酸氧化为二氧化碳,浓硫酸被还原为二氧化硫,还有水生成,故化学方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。


科目:高中化学 来源: 题型:
【题目】向 50mL 稀 H2SO4 与稀 HNO3 的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标 准状况下)之间的关系如图所示,且每一段只对应一个反应。下列说法正确的是( )

A. 参加反应铁粉的总质量 m2=5.6 g
B. 所用混合溶液中 c(HNO3)=0.5 molL-1
C. 开始时产生的气体为 H2
D. AB 段产生的反应为置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图的转化关系判断,下列说法正确的是(反应条件已略去)

A. 生成等质量H2时,①和②反应消耗n (HCl)=n (NaOH)
B. 反应③中氧化剂与还原剂的物质的量之比为2︰3
C. 反应③和④消耗等量的Al时,生成的n (Cu)︰n (Fe)=3︰2
D. 反应⑤的离子方程式为Al3+ + 3OH—===Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:

(1)连接上述仪器的正确顺序是:E接 , 接 , 接 , 接F.____________
(2)气体发生装置中进行的反应化学方程式是_________________;当0.5mol MnO2参与反应时,被氧化的HCl的质量为____________,生成的Cl2在标准状况下的体积约为____________.
(3)在装置中:①饱和食盐水的作用是______________,②浓硫酸的作用是__________.
(4)化学实验中检验是否有Cl2产生常用湿润的淀粉﹣KI试纸.如果有Cl2产生,可观察到的现象是__________________,写出反应方程式__________________.
(5)写出尾气吸收装置中进行的反应的化学方程式_______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() I是常规核裂变产物之一,可以通过测定大气或水中的
I是常规核裂变产物之一,可以通过测定大气或水中的 ![]() I含量变化来检测核电站是否发生放射性物质泄漏.下列有关
I含量变化来检测核电站是否发生放射性物质泄漏.下列有关 ![]() I的叙述中错误的是( )
I的叙述中错误的是( )
A. ![]() I的原子核外电子数为53 B.
I的原子核外电子数为53 B. ![]() I与
I与 ![]() I互为同位素
I互为同位素
C. ![]() I的化学性质与
I的化学性质与 ![]() I相同 D.
I相同 D. ![]() I与
I与 ![]() I为同种核素
I为同种核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l) ![]() H=-632kJ·mol-1。右图为质子膜H2S燃料电池的示意图。下列说法不正确的是
H=-632kJ·mol-1。右图为质子膜H2S燃料电池的示意图。下列说法不正确的是

A. 电路中每流过2mol电子,电池内部释放316kJ热能
B. 每34gH2S参与反应,有2mol H+经质子膜进入正极区
C. 电极a为电池的负极
D. 电极b上发生的电极反应为:O2+4e![]() +4 H+=2H2O
+4 H+=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知:b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法不正确的是
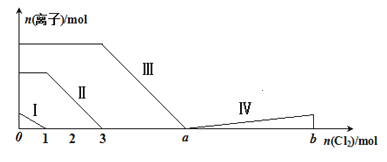
A. 线段Ⅱ表示Fe2+的变化情况
B. 线段Ⅳ发生反应的离子方程式为:I2+5Cl2+12OH-=2IO3-+10Cl-+6H2O
C. 根据图象可计算a=6
D. 原溶液中c(Fe2+)∶c(I-)∶c(Br-)=2∶1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 标准状况下,5.6LCl2与足量NaOH反应转移的电子数为0.25NA
B. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO32HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为N2H4+O2===N2+2H2O。下列说法正确的是( )

A. 甲池中负极上的电极反应式为N2H4-4e-===N2+4H+
B. 乙池中石墨电极上发生的反应为2H2O-4e-===4H++O2↑
C. 甲池溶液pH增大,乙池溶液pH减小
D. 甲池中每消耗0.1 mol N2H4乙池电极上则会析出6.4 g固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com