
【题目】两种气态烃组成的混合气体0.1 mol,完全燃烧得到7.04g CO2 和3.6g H2O ,下列说法不正确的是
A. 一定有甲烷B. 可能是甲烷和C3H4的混合气体
C. 一定没有乙烷D. 一定是甲烷和乙烯的混合气体
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】t ℃时,水的离子积为Kw,该温度下将a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,要使混合液呈中性,必要的条件是
A. 混合液中c(H+)=![]() B. 混合液的pH=7
B. 混合液的pH=7
C. a=b D. 混合液中c(B+)=c(A-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在pH=12的NaOH溶液中,由水电离生成的c(OH-)为
A. 1.0×10-7 mol·L-1 B. 1.0×10-6 mol·L-1
C. 1.0×10-2 mol·L-1 D. 1.0×10-12 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:
MnO2熔融氧化:3MnO2+ KClO3+ 6KOH![]() 3K2MnO4+ KCl+3H2O
3K2MnO4+ KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
将MnO2熔融氧化所得产物的热浸取液装入三颈烧瓶,再通入CO2气体,使K2MnO4歧化的过程在如图装置中进行,A、B、C、D、E为旋塞,F、G为气囊,H为带套管的玻璃棒。

回答下列问题:
(1)仪器a的名称是______。
(2)MnO2熔融氧化应放在______中加热(填仪器编号)。
①烧杯 ②瓷坩埚 ③蒸发皿 ④铁坩埚
(3)为了能充分利用CO2,装置中使用了两个气囊。当试管内依次加入块状碳酸钙和盐酸后,关闭旋塞B、E,微开旋塞A,打开旋塞C、D,往热K2MnO4溶液中通入CO2气体,未反应的CO2被收集到气囊F中。待气囊F收集到较多气体时,关闭旋塞______,打开旋塞______,轻轻挤压气囊F,使CO2气体缓缓地压入K2MnO4溶液中再次反应,未反应的CO2气体又被收集在气囊G中。然后将气囊G中的气体挤压入气囊F中,如此反复,直至K2MnO4完全反应。
(4)除去K2MnO4歧化产物中MnO2的操作方法是______。
(5)将三颈烧瓶中所得产物经过一系列操作得到针状的高锰酸钾晶体,最后采用低温烘干的方法来干燥产品,原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物有广泛的用途
(1)甲醇常作燃料,已知在常温常压下甲醇完全燃烧的热化学方程式如下:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH1。则2mol甲醇完全燃烧生成二氧化碳和气态水时反应的ΔH______ΔH1(填“大于”、“等于”或“小于”)
(2)煤的综合利用煤气化是将水蒸气通过红热的碳产生水煤气:C(s)+H2O(g)CO(g)+H2(g) ΔH=+131.3kJ·molˉ1,达到平衡后,下列能提高水煤气生成速率的措施是______。
A.升高温度 B.增加碳的用量 C.缩小体积 D.用CO吸收剂除去CO
(3)一定温度下,将一定量的C(s)和H2O(g)放入某恒容密闭容器中发生上述反应,得到如下数据:
达到平衡所需时间/s | 起始浓度/ mol·Lˉ1 | 平衡浓度/ mol·Lˉ1 |
H2O(g) | H2(g) | |
10 | 2.0 | 0.6 |
计算该反应从开始到平衡时,以CO表示的反应速率为______;H2O(g)的转化率为______。
(4)下列可以说明反应C(s)+H2O(g)CO(g)+H2(g)已经达到平衡状态的是____。
A.单位时间内生成nmolH2的同时,生成nmolCO
B.反应速率: (H2)= (CO)= (H2O)
C.c(H2O):c(CO):c(H2)=1:1:1
D.温度和体积一定时,混合气体的密度不再变化
E.温度和体积一定时,容器内的压强不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的示意图如图所示.已知:2PbSO4+2H2O![]() Pb+PbO2+2H2SO4
Pb+PbO2+2H2SO4

下列说法正确的是( )
A. 放电时,N 为负极,其电极反应式为:PbO2+SO42﹣+4H++2e﹣=PbSO4+2H2O
B. 放电时,c(H2SO4)不变,两极的质量增加
C. 充电时,阳极反应式为:PbSO4+2e﹣=Pb+SO42﹣
D. 充电时,若 N 连电源正极,则该极生成 PbO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.

请回答下列问题:
(1)甲池为______填“原电池”、“电解池”或“电镀池”),通入 CH3OH 电极的电极反应为_____.
(2)乙池中 A(石墨)电极的名称为_____(填“正极”、“负极”或“阴极”、“阳极”),总反应式为_____.
(3)当乙池中 B 极质量增加 5.40g 时,甲池中理论上消耗 O2 的体积为_____mL(标准状况),丙池中_____极析出_____g 铜.
(4)若丙中电极不变,将其溶液换成 NaCl 溶液,电键闭合一段时间后,丙中溶液的 pH 将______________填“增大”、“减小”或“不变”);甲中溶液的 pH 将________________ (填“增大”、“减小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CH4与Cl2发生反应的条件是________;实验中可观察到量筒内液面________,量筒内壁出现油状液滴,其中________是工业上重要的溶剂;饱和食盐水中有少量固体析出,用饱和食盐水而不用水的原因是______________________________。

(2)在浓硫酸作用下,苯在水浴加热时可以与浓硝酸反应生成硝基苯,该反应的化学方程式为_____________
(3)写出实验室制取乙酸乙酯的化学方程式:__________________________________;实验中饱和碳酸钠溶液的作用是(填字母)________________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如下图所示。下列有关叙述正确的是
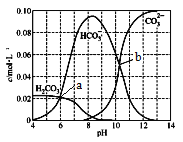
A. b点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)
B. 随pH增大,![]() 数值先减小后增大
数值先减小后增大
C. 25℃时,碳酸的第一步电离常数Ka1=10-6
D. 溶液呈中性时:c(HCO3- )>c(Cl-)>c(CO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com