
【题目】铅蓄电池的示意图如图所示.已知:2PbSO4+2H2O![]() Pb+PbO2+2H2SO4
Pb+PbO2+2H2SO4

下列说法正确的是( )
A. 放电时,N 为负极,其电极反应式为:PbO2+SO42﹣+4H++2e﹣=PbSO4+2H2O
B. 放电时,c(H2SO4)不变,两极的质量增加
C. 充电时,阳极反应式为:PbSO4+2e﹣=Pb+SO42﹣
D. 充电时,若 N 连电源正极,则该极生成 PbO2
【答案】D
【解析】
A.由铅蓄电池的总反应 PbO2+2H2SO4+Pb═2PbSO4+2H2O 可知,放电时,Pb 被氧化,则 M 应为电池负极反应,电极反应式为:Pb﹣2e﹣+SO42﹣=PbSO4,故 A 错误;
B.放电时,负极反应:Pb﹣2e﹣+SO42﹣=PbSO4,正极上:4H++PbO2+SO42﹣+2e﹣=2H2O+PbSO4,两个电极质量增加,但是反应中硫酸被消耗,浓度减小,故 B 错误;
C.充电时,阳极发生失电子的氧化反应,2H2O+PbSO4﹣2e﹣=4H++PbO2+SO42﹣,故 C 错误;
D.充电时, 若N连电源正极,该极上硫酸铅发生失电子的氧化反应: 2H2O+PbSO4 ﹣ 2e﹣ =4H++PbO2+SO42﹣,该极生成 PbO2,故 D 正确。
故选D。


科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的 pH 均增大
②在相同时间内, 两烧杯中产生气泡的速度: 甲__________乙(填“>”、 “<”或“=”)。
③请写出图中构成原电池的负极电极反应式: ____________。
④当甲中溶液质量增重 31.5 克时,电极上转移电子数目为______。
(2)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是 KOH。通甲烷一极的电极反应方程式为 ______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Fe3+、CO32﹣、SO42﹣、Cl﹣中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )

A. 原溶液一定存在CO32﹣和SO42﹣,一定不存在Fe3+
B. 原溶液一定存在Cl﹣,可能存在Na+
C. 原溶液中c(Cl﹣)≥0.1molL﹣1
D. 若原溶液中不存在Na+,则c(Cl﹣)<0.1molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放SO2、NO2会危害环境。工业上常采用化学方法控制污染。
(1)下图是1mol CH4完全燃烧生成气态水的能量变化和1molS(g)燃烧的能量变化。

①CH4完全燃烧的活化能是_____________kJ/mol
②在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式_____________________________;
(2)为减少SO2排放,将含SO2的烟气通过洗涤剂X,充分吸收后再向吸收后的溶液中加入稀硫酸,既可以回收![]() ,同时又可得到化肥。X可以是__________(填序号)。
,同时又可得到化肥。X可以是__________(填序号)。
a.Ca(OH)2 b.K2CO3 c.Na2SO3 d.NH3H2O
(3)对NO2+SO2![]() SO3+NO △H<0反应进行探究:在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率。实验结果如图所示:
SO3+NO △H<0反应进行探究:在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率。实验结果如图所示:

①能够加快该化学反应速率的外界条件是___________________
a.降低温度 b.增大压强 c.升高温度 d.减小压强
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是___________;
③若A点对应实验中,SO2(g)的起始浓度为c0mol/L,经过![]() min达到平衡状态,该时段化学反应速率v(NO2)___mol/(Lmin);
min达到平衡状态,该时段化学反应速率v(NO2)___mol/(Lmin);
④图中C、D两点对应的实验温度分别为![]() 和
和![]() ,计算判断
,计算判断![]() ______
______![]() (填>、=、或<)
(填>、=、或<)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体0.1 mol,完全燃烧得到7.04g CO2 和3.6g H2O ,下列说法不正确的是
A. 一定有甲烷B. 可能是甲烷和C3H4的混合气体
C. 一定没有乙烷D. 一定是甲烷和乙烯的混合气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c、d、e 为元素周期表中前 4 周期的一部分元素,下列有关叙述正确的是( )

A.元素 b 位于第ⅥA 族,有+6、-2 价两种常见化合价
B.五种元素中,元素 e 的性质最稳定
C.元素 c 和 d 的最高价氧化物对应的水化物的酸性:c>d
D.元素 c 和 e 的气态氢化物的稳定性:c>e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 1×105 Pa 和 298 K 时,将 1 mol 气态 AB 分子分离成气态 A 原子和 B 原子所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能(已知氨分子中有 3 个等价的氮氢共价键):
共价键 | H—H |
| N—H |
键能(kJ·mol-1) | 436 | 945 | 391 |
(1)根据上表中的数据判断工业合成氨的反应:
N2(g)+3H2(g)![]() 2NH3(g)是____________(填“吸热”或“放热”)反应。
2NH3(g)是____________(填“吸热”或“放热”)反应。
(2)在 298 K 时,取 1 mol 氮气和 3 mol 氢气放入一密闭容器中,在催化剂存在下进行反应。理论上放出或吸收的热量为 Q1,则 Q1=__________。
(3)实际生产中,放出或吸收的热量为 Q2,Q1 与 Q2 比较正确的是_______________(填选项号)。
A.Q1>Q2 B.Q1<Q2 C.Q1=Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一种丰富的资源,工业上可从海水中提取多种物质,广泛应用于生活、生产、科技等方面。下图是某工厂对海水资源进行综合利用的示意图。

回答下列问题:
(1)流程图中操作a的名称为________。(填序号)
A、蒸发结晶 B、降温结晶
(2)生产生石灰的方程式__________________________。从离子反应的角度思考,往海水中加入石灰乳的作用是____________________。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是_____________。
②操作b是在________氛围中进行,若在空气中加热,则会生成Mg(OH)2,
写出有关反应的化学方程式:________________________________________。
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为__________,从考虑成本和废物循环利用的角度,副产物氯气可以用于_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A—F 6种有机物,在一定条件下,按下图发生转化。
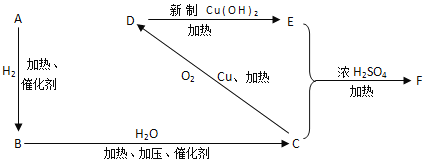
又知烃A与氢气的相对密度是13,试回答下列问题:
(1)有机物的名称:A._______,B._________,D.___________。
(2)有机物的结构简式:E._____________,F.____________。
(3)反应BC的化学方程式是___________,反应类型属于__________反应
CD的反应方程式是_____________________反应类型属于__________反应。
C + E→F的反应化学方程式______________________反应类型属于__________反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com