
����Ŀ����ˮ��һ�ַḻ����Դ����ҵ�ϿɴӺ�ˮ����ȡ�������ʣ��㷺Ӧ��������������Ƽ��ȷ��档��ͼ��ij�����Ժ�ˮ��Դ�����ۺ����õ�ʾ��ͼ��

�ش��������⣺
(1)����ͼ�в���a������Ϊ________��(�����)
A�������ᾧ B�����½ᾧ
(2)������ʯ�ҵķ���ʽ__________________________�������ӷ�Ӧ�ĽǶ�˼��������ˮ�м���ʯ�����������____________________��
(3)þ��һ����;�ܹ�Ľ������ϣ�Ŀǰ������60%��þ�Ӻ�ˮ����ȡ��
����Ҫ��֤������ˮMgCl2�в���NaCl����IJ���������_____________��
�ڲ���b����________��Χ�н��У����ڿ����м��ȣ��������Mg(OH)2��
д���йط�Ӧ�Ļ�ѧ����ʽ��________________________________________��
(4)��ˮMgCl2������״̬�£�ͨ�������Mg��Cl2���÷�Ӧ�Ļ�ѧ����ʽΪ__________���ӿ��dzɱ��ͷ���ѭ�����õĽǶȣ�������������������_______________��
���𰸡�A CaCO3![]() CaO��CO2�� ����Mg2�� �ýྻ�IJ�˿պȡ�������壬���ھƾ��ƻ��������ա�����ɫ�����������֤��������ˮ�Ȼ�þ�����в����Ȼ���(����ɫ��ӦҲ��) HCl(����) MgCl2��6H2O
CaO��CO2�� ����Mg2�� �ýྻ�IJ�˿պȡ�������壬���ھƾ��ƻ��������ա�����ɫ�����������֤��������ˮ�Ȼ�þ�����в����Ȼ���(����ɫ��ӦҲ��) HCl(����) MgCl2��6H2O![]() Mg(OH)2��2HCl��4H2O MgCl2(����)
Mg(OH)2��2HCl��4H2O MgCl2(����) ![]() Mg��Cl2�� �����ᣬѭ��ʹ��(�ӿ��dzɱ��ͷ���ѭ�����õĽǶȣ������������������������ᣬ����������ˮ����������ȡƯ�۵ȡ�)
Mg��Cl2�� �����ᣬѭ��ʹ��(�ӿ��dzɱ��ͷ���ѭ�����õĽǶȣ������������������������ᣬ����������ˮ����������ȡƯ�۵ȡ�)
��������
��1������a�ǴӺ�ˮ�з�������Σ�������Һ�з�����������ʣ�Ӧ�������ᾧ�ķ�����
��2��������ʯ�ҵ���Ҫԭ����Դ�ں����еı��ǣ���ĵ�ÿǵȣ����䷽��ʽΪCaCO3![]() CaO+CO2���������ӷ�Ӧ�ĽǶ�˼��������ˮ�м���ʯ����������dz���Mg2+��
CaO+CO2���������ӷ�Ӧ�ĽǶ�˼��������ˮ�м���ʯ����������dz���Mg2+��
��3�����ýྻ�IJ�˿պȡ�������壬���ھƾ��ƻ��������ա�����ɫ�����������֤��������ˮ�Ȼ�þ�����в����Ȼ�����
��ֱ���ڿ����м���MgCl2��6H2O����Mg2+��ˮ�������Mg��OH��2��HCl��ͨ��HCl����������ˮ����
��4����ˮMgCl2������״̬�£�ͨ�������Mg��Cl2�������������������������ᣬѭ��ʹ�á�
��1��������ͼ��֪������a�ǴӺ�ˮ�з�������Σ�������Һ�з�����������ʣ�Ӧ�������ᾧ�ķ�����
�ʴ�Ϊ��A��
��2��ʯ��������ʯ����ˮ�γɵĻ�����ӳ�����ú���ѧ��Դ����߾���Ч��ĽǶȿ��ǣ�������ʯ�ҵ���Ҫԭ����Դ�ں����еı��ǣ���ĵ�ÿǵȣ�������������ʽΪCaCO3![]() CaO+CO2���������ӷ�Ӧ�ĽǶ�˼��������ˮ�м���ʯ����������dz���Mg2+��
CaO+CO2���������ӷ�Ӧ�ĽǶ�˼��������ˮ�м���ʯ����������dz���Mg2+��
�ʴ�Ϊ��CaCO3![]() CaO+CO2��������Mg2+��
CaO+CO2��������Mg2+��
��3�����ýྻ�IJ�˿պȡ�������壬���ھƾ��ƻ��������ա�����ɫ�����������֤��������ˮ�Ȼ�þ�����в����Ȼ������ʴ�Ϊ���ýྻ�IJ�˿պȡ�������壬���ھƾ��ƻ��������ա�����ɫ�����������֤��������ˮ�Ȼ�þ�����в����Ȼ���(����ɫ��ӦҲ��)��
�����ֱ���ڿ����м���MgCl2��6H2O����Mg2+��ˮ�������Mg��OH��2��HCl��ͨ��HCl����������ˮ�����䷴Ӧ����ʽΪ��MgCl2��6H2O![]() Mg(OH)2��2HCl��4H2O���ʴ�Ϊ��HCl��MgCl2��6H2O
Mg(OH)2��2HCl��4H2O���ʴ�Ϊ��HCl��MgCl2��6H2O![]() Mg(OH)2��2HCl��4H2O��
Mg(OH)2��2HCl��4H2O��
��4����ˮMgCl2������״̬�£�ͨ�������Mg��Cl2���÷�Ӧ�Ļ�ѧ����ʽΪMgCl2(����)![]() Mg��Cl2�����ӿ��dzɱ��ͷ���ѭ�����õĽǶȣ������������������������ᣬѭ��ʹ��(�ӿ��dzɱ��ͷ���ѭ�����õĽǶȣ������������������������ᣬ����������ˮ����������ȡƯ�۵ȡ�)
Mg��Cl2�����ӿ��dzɱ��ͷ���ѭ�����õĽǶȣ������������������������ᣬѭ��ʹ��(�ӿ��dzɱ��ͷ���ѭ�����õĽǶȣ������������������������ᣬ����������ˮ����������ȡƯ�۵ȡ�)
�ʴ�Ϊ��MgCl2(����)![]() Mg��Cl2���������ᣬѭ��ʹ��(�ӿ��dzɱ��ͷ���ѭ�����õĽǶȣ������������������������ᣬ����������ˮ����������ȡƯ�۵ȡ�)
Mg��Cl2���������ᣬѭ��ʹ��(�ӿ��dzɱ��ͷ���ѭ�����õĽǶȣ������������������������ᣬ����������ˮ����������ȡƯ�۵ȡ�)


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ�ס�����ʾװ�ý���ʵ�飬ͼ�������ձ������ҺΪͬŨ�ȵ�ϡ���ᣬ����GΪ�����ơ���ش���������
�� ��
��
(1)���������У���ȷ����______��
A.����пƬ�Ǹ���������ͭƬ������
B.���ձ���ͭƬ����������ݲ���
C.���ձ�����Һ��pH������
D.���е�����ͭƬ����������пƬ
E.����Һ��![]() ��ͭƬ�����ƶ�
��ͭƬ�����ƶ�
(2)�仯����������ת������ʽ��Ҫ�ǣ���Ϊ____����Ϊ_____��
(3)����Ӧ��������![]() ���ӷ���ת�ƣ������ɵ������ڱ���µ����Ϊ__________
���ӷ���ת�ƣ������ɵ������ڱ���µ����Ϊ__________
(4)ԭ����ڹ���ʱ�����з�Ӧ��������Ϊԭ��ع���ʱ�����ķ�Ӧ���ǣ�______
A.![]()
B.![]()
C.![]()
D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ���ص�ʾ��ͼ��ͼ��ʾ����֪��2PbSO4+2H2O![]() Pb+PbO2+2H2SO4
Pb+PbO2+2H2SO4

����˵����ȷ����( )
A. �ŵ�ʱ��N Ϊ��������缫��ӦʽΪ��PbO2+SO42��+4H++2e��=PbSO4+2H2O
B. �ŵ�ʱ��c(H2SO4)���䣬��������������
C. ���ʱ��������ӦʽΪ��PbSO4+2e����Pb+SO42��
D. ���ʱ���� N ����Դ��������ü����� PbO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ��������һ�ּ��û���������Һ����������ʯī���缫��ⱥ���Ȼ�����Һ��ͨ��ʱ��ΪʹCl2����ȫ���գ��Ƶ��н�ǿɱ������������Һ���������ͼ��װ�á��Ե�Դ�缫���ƺ�����Һ����Ҫ�ɷ��ж���ȷ����
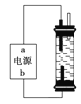
A. a������b������NaClO��NaCl
B. a������b������NaClO��NaCl
C. a������b������HClO��NaCl
D. a������b������HClO��NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)CH4��Cl2������Ӧ��������________��ʵ���пɹ۲쵽��Ͳ��Һ��________����Ͳ�ڱڳ�����״Һ�Σ�����________�ǹ�ҵ����Ҫ���ܼ�������ʳ��ˮ�������������������ñ���ʳ��ˮ������ˮ��ԭ����______________________________��

(2)��Ũ���������£�����ˮԡ����ʱ������Ũ���ᷴӦ�������������÷�Ӧ�Ļ�ѧ����ʽΪ_____________
(3)д��ʵ������ȡ���������Ļ�ѧ����ʽ��__________________________________��ʵ���б���̼������Һ��������(����ĸ)________________��
A���к�������Ҵ�
B���к����Ტ���ղ����Ҵ�
C�����������ڱ���̼������Һ�е��ܽ�ȱ���ˮ�и�С�������ڷֲ�����
D�������������ɣ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ʦΪ������������Ʒ�Ӧ���������ͼװ�õ�ʵ�顣ʵ��������ȸ���Ԥ�ȣ��������ڳ�Բ��ʱ������ͨ�����������ɼ����Ż�ȼ�գ����ɴ������̡����������д������

A.�����ķ�ӦΪ��2Na+Cl2![]() 2NaCl
2NaCl
B.������β����һ�Ž���NaOH��Һ���������������չ���������
C.���Ż�ȼ�ղ�����ɫ����
D.�����������ص�һ��ʯ����Һ���ɸ�����ɫ�仯�ж������Ƿ�Һ��ȫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��ͬѧ���������ʵ�飬�漰�������й�ʵ���������ʵ��Ϊʳ�εľ��ƣ���ʵ��ͨ�����Ƶ�ʳ��������0.4mol��L-1���Ȼ�����Һ��

��1����ʵ���г�ȥ���������ʵIJ���������___________����д������ţ������йؼ�ʵ�����������___________��
��2����ʵ���У�Ϊ��Ч��ȥ�����е�Ca2+��Mg2+��SO42-���ʣ����ƹ����м����Լ���
��NaOH��Һ��Na2CO3��Һ��BaCl2��Һ�����ᣬ�����ļ���˳��Ϊ____������ţ������м���NaOH��Һ��������Ӧ�����ӷ���ʽΪ________________��
��3����ʵ�飬ʹ��������ǰ������е�һ��������______������ʱ���������������⣬�������õ��IJ���������_____________��
��4����ʵ�������NaCl����Ϊ________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽ�ζ���ȷ��ȡ25.00mLijδ֪Ũ�ȵ���������һ�ྻ����ƿ�У�Ȼ����0.20mol��L -1������������Һ(ָʾ��Ϊ��̪).�ζ�������£�
NaOH��ʼ���� | NaOH�յ���� | |
��һ�� | 0.10mL | 18.60mL |
�ڶ��� | 0.30mL | 18.00mL |
��1�������������ݿ��Լ������������ʵ���Ũ��Ϊ_____________mol��L-1.
��2���ﵽ�ζ��յ�ı�־��_______________________________________________________
��3�����²�����ɲⶨ���ƫ�ߵ�ԭ�������__________________��
A. �ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�������������ȷ
B. �ζ����յ����ʱ���ֵζ��ܼ��촦����һ����Һ
C. ʢװδ֪Һ����ƿ������ˮϴ����δ�ô���Һ��ϴ
D. δ�ñ�Һ��ϴ��ʽ�ζ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͨ�������£�����ͼ��ʾװ�����Ҷ�ȩ(OHC-CHO)�Ʊ��Ҷ���(H00C-COOH)�����Ʊ���ӦΪ��OHC-CHO+2Cl2+2H2O��HOOC-COOH+4HCl������˵����ȷ����( )

A. ���������ṩCl-����ǿ�����Ե�����
B. Pt1�ĵ缫��ӦΪ��4OH--4e-=2H2O+O2��
C. ÿ����0.1mol�Ҷ�ȩ��Pt1���ų�2.24L����(��״��)
D. ÿ�õ�lmol�Ҷ��Ὣ��2molH+������Ǩ�Ƶ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com