
����Ŀ������ʽ�ζ���ȷ��ȡ25.00mLijδ֪Ũ�ȵ���������һ�ྻ����ƿ�У�Ȼ����0.20mol��L -1������������Һ(ָʾ��Ϊ��̪).�ζ�������£�
NaOH��ʼ���� | NaOH�յ���� | |
��һ�� | 0.10mL | 18.60mL |
�ڶ��� | 0.30mL | 18.00mL |
��1�������������ݿ��Լ������������ʵ���Ũ��Ϊ_____________mol��L-1.
��2���ﵽ�ζ��յ�ı�־��_______________________________________________________
��3�����²�����ɲⶨ���ƫ�ߵ�ԭ�������__________________��
A. �ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�������������ȷ
B. �ζ����յ����ʱ���ֵζ��ܼ��촦����һ����Һ
C. ʢװδ֪Һ����ƿ������ˮϴ����δ�ô���Һ��ϴ
D. δ�ñ�Һ��ϴ��ʽ�ζ���
���𰸡�0.1448mol/L �μ����һ��ʱ����Һ��ɫ����ɫ��ɷۺ�ɫ���Ұ����֮�ڲ���ɫ BD
��������
��1��������������������Һ��ƽ���������c�����⣩��c��������V������/ V�����⣩���c�����ᣩ����2���ζ��յ�ǰ����ҺӦΪ��ɫ������ζ��յ�ʱ��ҺΪ��ɫ���Դ����жϵζ��յ㣻��3������c�����⣩��c��������V������/ V�����⣩�����еζ���������
��1���ɱ���֪����һ�εζ����ĵ�V(NaOH������18.60��0.10��mL��18.50mL���ڶ��εζ�����V(NaOH������18.00��0.30��mL��17.70mL��ƽ�����ĵ�V(NaOH����18.10 mL��c��NaOH����![]() mol/L=0.1448 mol/L���ʴ�Ϊ0.1448��
mol/L=0.1448 mol/L���ʴ�Ϊ0.1448��
��2���ζ�����֮ǰ����ҺӦΪ��ɫ������ʱ��ɺ�ɫ���ζ��յ㣺�����һ����Һ����ɫ��dz��ɫ��������ڲ���ɫ��
��3��A���ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�������������ȷ������V(NaOH��ƫ�ͣ���c�����⣩��c��������V������/ V�����⣩��֪��c�����⣩ƫ�ͣ��£��ζ����յ����ʱ���ֵζ��ܼ��촦����һ����Һ������V(NaOH��ƫ�ߣ���c�����⣩��c��������V������/ V�����⣩��֪��c�����⣩ƫ��C��ʢװδ֪Һ����ƿ������ˮϴ����δ�ô���Һ��ϴ��������ȷ���Խ����Ӱ�죻D��δ�ñ�Һ��ϴ��ʽ�ζ��ܣ�����V(NaOH��ƫ�ߣ���c�����⣩��c��������V������/ V�����⣩��֪��c�����⣩ƫ�ߡ�������������ɲⶨ���ƫ�ߵ���BD��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ֱ���ŷ�SO2��NO2��Σ����������ҵ�ϳ����û�ѧ����������Ⱦ��
(1)��ͼ��1mol CH4��ȫȼ��������̬ˮ�������仯��1molS(g)ȼ�յ������仯��

��CH4��ȫȼ�յĻ����_____________kJ/mol
���ڴ��������£�CH4���Ի�ԭSO2���ɵ���S(g)��H2O(g)��CO2��д���÷�Ӧ���Ȼ�ѧ����ʽ_____________________________��
(2)Ϊ����SO2�ŷţ�����SO2������ͨ��ϴ�Ӽ�X��������պ��������պ����Һ�м���ϡ���ᣬ�ȿ��Ի���![]() ��ͬʱ�ֿɵõ����ʡ�X������__________(�����)��
��ͬʱ�ֿɵõ����ʡ�X������__________(�����)��
a.Ca(OH)2 b.K2CO3 c.Na2SO3 d.NH3H2O
(3)��NO2+SO2![]() SO3+NO ��H<0��Ӧ����̽�����ڹ̶�������ܱ������У�ʹ��ij�ִ������ı�ԭ������Ƚ��ж���ʵ��(����ʵ����¶ȿ�����ͬ��Ҳ���ܲ�ͬ)���ⶨNO2��ƽ��ת���ʡ�ʵ������ͼ��ʾ��
SO3+NO ��H<0��Ӧ����̽�����ڹ̶�������ܱ������У�ʹ��ij�ִ������ı�ԭ������Ƚ��ж���ʵ��(����ʵ����¶ȿ�����ͬ��Ҳ���ܲ�ͬ)���ⶨNO2��ƽ��ת���ʡ�ʵ������ͼ��ʾ��

���ܹ��ӿ�û�ѧ��Ӧ���ʵ����������___________________
a.�����¶� b.����ѹǿ c.�����¶� d.��Сѹǿ
�����Ҫ��ͼ��C���ƽ��״̬�ı�ΪB���ƽ��״̬��Ӧ��ȡ�Ĵ�ʩ��___________��
����A���Ӧʵ���У�SO2(g)����ʼŨ��Ϊc0mol/L������![]() min�ﵽƽ��״̬����ʱ�λ�ѧ��Ӧ����v(NO2)___mol/(Lmin)��
min�ﵽƽ��״̬����ʱ�λ�ѧ��Ӧ����v(NO2)___mol/(Lmin)��
��ͼ��C��D�����Ӧ��ʵ���¶ȷֱ�Ϊ![]() ��
��![]() �������ж�
�������ж�![]() ______
______![]() (���������)
(���������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ��һ�ַḻ����Դ����ҵ�ϿɴӺ�ˮ����ȡ�������ʣ��㷺Ӧ��������������Ƽ��ȷ��档��ͼ��ij�����Ժ�ˮ��Դ�����ۺ����õ�ʾ��ͼ��

�ش��������⣺
(1)����ͼ�в���a������Ϊ________��(�����)
A�������ᾧ B�����½ᾧ
(2)������ʯ�ҵķ���ʽ__________________________�������ӷ�Ӧ�ĽǶ�˼��������ˮ�м���ʯ�����������____________________��
(3)þ��һ����;�ܹ�Ľ������ϣ�Ŀǰ������60%��þ�Ӻ�ˮ����ȡ��
����Ҫ��֤������ˮMgCl2�в���NaCl����IJ���������_____________��
�ڲ���b����________��Χ�н��У����ڿ����м��ȣ��������Mg(OH)2��
д���йط�Ӧ�Ļ�ѧ����ʽ��________________________________________��
(4)��ˮMgCl2������״̬�£�ͨ�������Mg��Cl2���÷�Ӧ�Ļ�ѧ����ʽΪ__________���ӿ��dzɱ��ͷ���ѭ�����õĽǶȣ�������������������_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��pH��2��A��B����һԪ����Һ��1mL, �ֱ��ˮϡ�͵�1000mL,����Һ��pH����Һ���(V)�Ĺ�ϵ��ͼ��ʾ, ������˵����ȷ����

A. A��B��������Һ���ʵ���Ũ��һ�����
B. ϡ�ͺ�A����Һ�����Ա�B����Һǿ
C. a �� 5ʱ, A������, B��ǿ��
D. ��A��B��������, ��5 > a > 2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������л��ϳɡ���ص�����������Ҫ�����á�
I. ![]() ���Ʊ���Ӧ������ͼ��ʾ��
���Ʊ���Ӧ������ͼ��ʾ��

(1)�Ԫ����Ԫ�����ڱ��е�λ��_______________________��
(2)д��A�ĵ���ʽ___________________________��
(3)![]() ���л��ϳ��г��õĻ�ԭ������д����Ӧ�۵Ļ�ѧ����ʽ_________________��
���л��ϳ��г��õĻ�ԭ������д����Ӧ�۵Ļ�ѧ����ʽ_________________��
II.�������������������ӵ�ص���ѡ�缫���ϣ���������Ϊ������ʯīΪ����������������李��Ȼ�﮻����Һ��������������﮳�������800�����ҡ����������Χ�������Ƶá�������ӵ���У���Ҫһ���л��ۺ�����Ϊ������֮�������Ǩ�ƵĽ��ʣ����л��ۺ���ĵ���֮һ(��M��ʾ)�Ľṹ��ʽ���£�

��ش��������⣺
(4)�Ʊ���������ﮱ����ڶ��������Χ�н��У���ԭ����_______________��
(5)����������������﮵ĵ缫��ӦʽΪ___________________��
(6)д��M����������������Һ��Ӧ�Ļ�ѧ����ʽ_____________________��
(7)�õ�س��ʱ�����������������������������ŵ�ʱ�����ĵ缫��ӦʽΪ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������10g̼���ƺ�̼�����ƵĻ���������������ٱ仯,ʣ���������8.45g��ʣ��������__________����Ӧ����ʽΪ___________ԭ�������̼������������Ϊ_______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��F 6���л����һ�������£�����ͼ����ת����
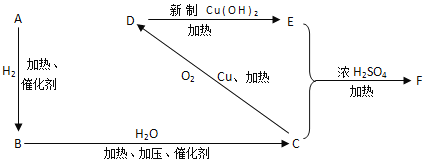
��֪��A������������ܶ���13���Իش��������⣺
(1)�л�������ƣ�A��_______��B��_________��D��___________��
(2)�л���Ľṹ��ʽ��E��_____________��F��____________��
(3)��ӦBC�Ļ�ѧ����ʽ��___________����Ӧ��������__________��Ӧ
CD�ķ�Ӧ����ʽ��_____________________��Ӧ��������__________��Ӧ��
C + E��F�ķ�Ӧ��ѧ����ʽ______________________��Ӧ��������__________��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�Ǿ����Դ���⣬�Ӻ�ˮ����ȡʳ�κ���Ĺ�����ͼ��ʾ����������������ǣ�

A. ������ˮ�ķ�����Ҫ�������������������ӽ�����
B. ��NaClΪԭ�Ͽ��������ռ��������ơ�����������Ȼ�����Ʒ
C. ������й����ȿ��������壬����Ϊ���������ܶȱȿ������ܶ�С
D. ��SO2ˮ��Һ����Br2�����ӷ�Ӧ����ʽΪ��Br2+SO2+2H2O�T4H++SO42��+2Br��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ���й����ʵ���Ũ�ȹ�ϵ��ȷ����(����)
A. 0.1 mol/L��NaHA��Һ����pH��4��c(HA��)��c(H��)��c(H2A)��c(A2��)
B. NaHCO3��Һ�У�c(H��)��c(H2CO3)��c(OH��)
C. �����£���pH��1��CH3COOH��Һ��pH��13��NaOH��Һ�������ϣ���Һ������Ũ�ȴ�С��˳��Ϊ��c(Na��)��c(CH3COO��)��c(OH��)��c(H��)
D. �����£���pH��8��NaA��Һ�У�c(Na��)��c(A��)��9.9��10��7 mol/L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com