
【题目】在 1×105 Pa 和 298 K 时,将 1 mol 气态 AB 分子分离成气态 A 原子和 B 原子所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能(已知氨分子中有 3 个等价的氮氢共价键):
共价键 | H—H |
| N—H |
键能(kJ·mol-1) | 436 | 945 | 391 |
(1)根据上表中的数据判断工业合成氨的反应:
N2(g)+3H2(g)![]() 2NH3(g)是____________(填“吸热”或“放热”)反应。
2NH3(g)是____________(填“吸热”或“放热”)反应。
(2)在 298 K 时,取 1 mol 氮气和 3 mol 氢气放入一密闭容器中,在催化剂存在下进行反应。理论上放出或吸收的热量为 Q1,则 Q1=__________。
(3)实际生产中,放出或吸收的热量为 Q2,Q1 与 Q2 比较正确的是_______________(填选项号)。
A.Q1>Q2 B.Q1<Q2 C.Q1=Q2
【答案】放热 93 kJ A
【解析】
(1)焓变等于断裂化学键吸收的能量减去成键释放的能量;
(2)合成氨为放热反应,且热化学方程式中为完全转化时的能量变化;
(3)合成氨为可逆反应,不能完全转化。
(1)N2(g) + 3H2(g) ![]() 2NH3(g),
2NH3(g),![]() H= (945+3
H= (945+3![]() 436- 6
436- 6![]() 391) kJ/mol= - 93kJ/mol< 0,为放热反应,故答案为:放热;
391) kJ/mol= - 93kJ/mol< 0,为放热反应,故答案为:放热;
(2)1mol氮气和3mol氢气理论上完全反应,放出热量为93kJ,故答案为:93kJ ;
(3)该反应为可逆反应,在密闭容器中反应达到平衡时,1molN2和3molH2不能完全反应生成2molNH3,因而放出的热量小于93kJ,则Q1>Q2,故答案为: A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】贝诺酯是一种新型抗炎、解热、镇痛药,其结构如下所示。下列对该化合物叙述正确的是( )

A. 贝诺酯分子式C17H14O5N
B. 贝诺酯属于芳香烃
C. 贝诺酯属于高分子化合物
D. 已知贝诺酯的水解产物之一为对氨基乙酰酚(![]() ),在核磁共振氢谱中,对氨基乙酰酚有5种峰
),在核磁共振氢谱中,对氨基乙酰酚有5种峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:
MnO2熔融氧化:3MnO2+ KClO3+ 6KOH![]() 3K2MnO4+ KCl+3H2O
3K2MnO4+ KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
将MnO2熔融氧化所得产物的热浸取液装入三颈烧瓶,再通入CO2气体,使K2MnO4歧化的过程在如图装置中进行,A、B、C、D、E为旋塞,F、G为气囊,H为带套管的玻璃棒。

回答下列问题:
(1)仪器a的名称是______。
(2)MnO2熔融氧化应放在______中加热(填仪器编号)。
①烧杯 ②瓷坩埚 ③蒸发皿 ④铁坩埚
(3)为了能充分利用CO2,装置中使用了两个气囊。当试管内依次加入块状碳酸钙和盐酸后,关闭旋塞B、E,微开旋塞A,打开旋塞C、D,往热K2MnO4溶液中通入CO2气体,未反应的CO2被收集到气囊F中。待气囊F收集到较多气体时,关闭旋塞______,打开旋塞______,轻轻挤压气囊F,使CO2气体缓缓地压入K2MnO4溶液中再次反应,未反应的CO2气体又被收集在气囊G中。然后将气囊G中的气体挤压入气囊F中,如此反复,直至K2MnO4完全反应。
(4)除去K2MnO4歧化产物中MnO2的操作方法是______。
(5)将三颈烧瓶中所得产物经过一系列操作得到针状的高锰酸钾晶体,最后采用低温烘干的方法来干燥产品,原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的示意图如图所示.已知:2PbSO4+2H2O![]() Pb+PbO2+2H2SO4
Pb+PbO2+2H2SO4

下列说法正确的是( )
A. 放电时,N 为负极,其电极反应式为:PbO2+SO42﹣+4H++2e﹣=PbSO4+2H2O
B. 放电时,c(H2SO4)不变,两极的质量增加
C. 充电时,阳极反应式为:PbSO4+2e﹣=Pb+SO42﹣
D. 充电时,若 N 连电源正极,则该极生成 PbO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.

请回答下列问题:
(1)甲池为______填“原电池”、“电解池”或“电镀池”),通入 CH3OH 电极的电极反应为_____.
(2)乙池中 A(石墨)电极的名称为_____(填“正极”、“负极”或“阴极”、“阳极”),总反应式为_____.
(3)当乙池中 B 极质量增加 5.40g 时,甲池中理论上消耗 O2 的体积为_____mL(标准状况),丙池中_____极析出_____g 铜.
(4)若丙中电极不变,将其溶液换成 NaCl 溶液,电键闭合一段时间后,丙中溶液的 pH 将______________填“增大”、“减小”或“不变”);甲中溶液的 pH 将________________ (填“增大”、“减小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置。对电源电极名称和消毒液的主要成分判断正确的是
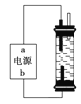
A. a为正极,b为负极;NaClO和NaCl
B. a为负极,b为正极;NaClO和NaCl
C. a为阳极,b为阴极;HClO和NaCl
D. a为阴极,b为阳极;HClO和NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CH4与Cl2发生反应的条件是________;实验中可观察到量筒内液面________,量筒内壁出现油状液滴,其中________是工业上重要的溶剂;饱和食盐水中有少量固体析出,用饱和食盐水而不用水的原因是______________________________。

(2)在浓硫酸作用下,苯在水浴加热时可以与浓硝酸反应生成硝基苯,该反应的化学方程式为_____________
(3)写出实验室制取乙酸乙酯的化学方程式:__________________________________;实验中饱和碳酸钠溶液的作用是(填字母)________________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学欲完成两个实验,涉及到下列有关实验操作。甲实验为食盐的精制,乙实验通过精制的食盐来配制0.4mol·L-1的氯化钠溶液。

(1)甲实验中除去难溶性杂质的操作步骤是___________(填写上述序号),其中关键实验操作名称是___________。
(2)甲实验中,为有效除去粗盐中的Ca2+、Mg2+、SO42-杂质,精制过程中加入试剂:
①NaOH溶液②Na2CO3溶液③BaCl2溶液④盐酸,合理的加入顺序为____(填序号)。其中加入NaOH溶液所发生反应的离子方程式为________________。
(3)乙实验,使用仪器③前必须进行的一步操作是______。配制时,除了上述仪器外,还可能用到的玻璃仪器是_____________。
(4)乙实验称量的NaCl质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为Na2CO3)吸收烟气中的 SO2,得到亚硫酸钠(Na2SO3)粗品。其流程如下:

(1)为加快工业废碱渣中 Na2CO3 的溶解,可采取的措施是_____(写出一种即可)。
(2)上述流程中,加入NaOH 后,发生反应的化学方程式为_____。
(3)亚硫酸钠粗品中含有少量Na2SO4,原因是_____。
(4)设计实验证明亚硫酸钠粗品含有少量 Na2SO4 的方案是:在一支试管中,加入少量 亚硫酸钠粗品,用适量蒸馏水溶解,_____,出现白色沉淀,则证明含有 Na2SO4。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com