
酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
回答下列问题:
(1)SnCl2用盐酸而不用水直接溶解的原因是
加入锡粉的作用是
(2)反应I生成的沉淀为SnO,写出该反应的化学方程式:
(3)检验沉淀已经“洗涤”干净的操作是: (3分)
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH。若溶液中c(Sn2+)=1.0mol·L—1,则室温下应控制溶液pH 。(已知:Ksp[Sn(OH)2]=1.0×10—26)
(5)酸性条件下,SnSO4还可用作双氧水的去除剂,试写出所发生反应的离子方程式:
。
(6)潮湿环境中,镀锡铜即使锡层破损也能防止形成铜绿,请结合有关的原理解释其原因:
。
(1)抑制Sn2+水解, 防止Sn2+被氧化 (2)SnCl2 + Na2CO3 =" SnO" + CO2↑+2NaCl(3)取少量最后一次洗涤液于试管中,滴入几滴AgNO3溶液,若无白色沉淀生成,则说明沉淀已洗涤干净(3分)(4)小于1 (2分。若写成≤1给1分) (5)Sn2+ + H2O2 + 2H+ = Sn4+ + 2H2O (6)潮湿环境中,Sn与Cu构成原电池,Sn作为负极,保护正极Cu不被氧化
解析试题分析:(1)SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;(2)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,离子方程式为:Sn2++CO32-═SnO↓+CO2↑;(3)检验沉淀已经“漂洗”干净的方法是:取最后一次洗涤液,向其中加入AgNO3溶液,若无沉淀,则说明洗涤干净;(4)根据 Ksp[Sn(OH)2]=1.0×10-26=c(OH-)2×c(Sn2+),将c(Sn2+)=1.0mol?L-1带人可得c(OH-)=10-13mol/L,c(H+)=0.1mol/L,故PH小于1,Sn2+完全沉淀;(5)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+═Sn4++2H2O;(6)潮湿环境中,Sn与Cu构成原电池,Sn作为负极,保护正极Cu不被氧化。
考点:物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计。


科目:高中化学 来源: 题型:填空题
某二元酸(化学式用H2B表示)在水中的电离方程式是H2B===H++HB-;HB- H++B2-。回答下列问题。
H++B2-。回答下列问题。
(1)Na2B溶液显_____(填“酸性”、“中性”或“碱性”),理由是_______(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是____。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,则0.1 mol·L-1 H2B溶液中的氢离子的物质的量浓度可能____0.11 mol·L-1(填“<”、“>”或“=”),理由是_____。
(4)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃)。
| 电解质 | 电离方程式 | 电离常数K | Ksp |
| H2CO3 | H2CO3 HCO3-+H+ HCO3-+H+HCO3-  CO32-+H+ CO32-+H+ | K1=4.31×10-7 K2=5.61×10-11 | - |
| C6H5OH | C6H5OH C6H5O-+H+ C6H5O-+H+ | 1.1×10-10 | - |
| H3PO4 | H3PO4 H2PO4-+H+ H2PO4-+H+H2PO4-  HPO42-+H+ HPO42-+H+HPO42-  PO43-+H+ PO43-+H+ | K1=7.52×10-3 K2=6.23×10-6 K1=2.20×10-13 | - |
| NH3·H2O | NH3·H2O OH-+NH4+ OH-+NH4+ | 1.76×10-5 | - |
| BaSO4 | BaSO4(s) Ba2++SO42- Ba2++SO42- | - | 1.07×10-10 |
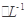 C6H5OH溶液中水的电离程度
C6H5OH溶液中水的电离程度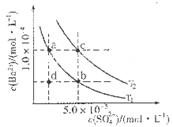
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
| A.c(NH4+)>c(Cl-)>c(OH-)>c(H+) | B.c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| C.c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D.c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上向氨化的CaSO4悬浊液中通入适量CO2,可制取(NH4)2SO4,其流程如下图所示,已知CaSO4的Ksp=9.1×10-6,CaCO3的Ksp=2.8×10-9,请回答: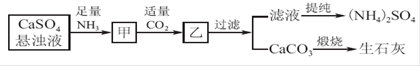
(1)向甲中通入过量CO2_____(填“有”或“不”)利于CaCO3和(NH4)2SO4的生成,原因是_______________________________________________________________。
(2)直接蒸干滤液得到的(NH4)2SO4主要含有的杂质是________(填含量最多的一种)。
(3)锅炉水垢中含有的CaSO4,可先用Na2CO3溶液浸泡,使之转化为疏松,易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为____________________________________。
②请分析CaSO4转化为CaCO3的原理:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常温下水存在电离平衡,H2O H++OH? ,请回答:
H++OH? ,请回答:
①若升高温度,电离程度将 ,溶液呈 性。
②向其中加入少量稀氨水,水的电离平衡 移动,溶液的PH 。
③若向其中加入少量NaHSO4溶液,水的离子积常数 ,由水电离出的c(H+) c(OH_).
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
按要求完成下列化学反应式
(1)硫酸氢钠在水溶液中的电离方程式 ;
(2)Na2CO3溶液水解的离子方程式 ;
(3)Al2(SO4)3溶液与NaHCO3溶液混合反应的离子方程式 ;
(4)Mg3N2与水反应的化学方程式 ;
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电离度表示电解质的相对强弱,电离度的定义:
α=(已电离的电解质分子数/溶液中原有电解质的总分子数)×100%。
已知25℃时几种物质(微粒)的电离度(溶液浓度均为0.1 mol·L-1)如下表:
| 编号 | 物质(微粒) | 电离度α |
| A | 硫酸溶液(第一步完全电离): 第二步 HSO4- H++SO42- H++SO42- | 10% |
| B | 硫酸氢钠溶液: HSO4- H++SO42 H++SO42 | 29% |
| C | 醋酸: CH3COOH CH3COO-+H+ CH3COO-+H+ | 1.33% |
| D | 盐酸: HCl=H++Cl- | 100% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3 H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式_____________________________________。
②某温度下,0.1000 mol·L-1的H3PO3溶液pH的读数为1.6,即此时溶液中c (H+) = 2.5×10-2 mol·L-1,除OH—之外其他离子的浓度由小到大的顺序是 ,该温度下H3PO3电离平衡的平衡常数K= 。(H3PO3第二步电离忽略不计,结果保留两位有效数字)
③向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中c(Na+)_______ c(H2PO3-)+ 2c(HPO32-)(填“>”、 “<” 或“=”)。
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式_______________________。
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
①阴极的电极反应式为_____________________________。
②产品室中反应的离子方程式为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com