
按要求完成下列化学反应式
(1)硫酸氢钠在水溶液中的电离方程式 ;
(2)Na2CO3溶液水解的离子方程式 ;
(3)Al2(SO4)3溶液与NaHCO3溶液混合反应的离子方程式 ;
(4)Mg3N2与水反应的化学方程式 ;
(1) NaHSO4 = Na+ + H+ + SO42-
(2)CO32-+H2O HCO3-+OH-;HCO3-+H2O
HCO3-+OH-;HCO3-+H2O H2CO3+OH- ;
H2CO3+OH- ;
(3)Al3++3HCO3-=Al(OH)3↓+3CO2 ↑ ;
(4)Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
解析试题分析:(1)硫酸氢钠为强酸酸式盐,电离产生Na+、H+、SO42?,可得电离方程式。
(2)CO32?分步水解:CO32-+H2O HCO3-+OH-;HCO3-+H2O
HCO3-+OH-;HCO3-+H2O H2CO3+OH-。
H2CO3+OH-。
(3)Al3+与HCO3?发生相互促进的水解反应:Al3++3HCO3-=Al(OH)3↓+3CO2 ↑。
(4)氮化镁与水反应生成氢氧化镁和氨气:Mg3N2+6H2O=3Mg(OH)2+2NH3↑。
考点:本题考查


科目:高中化学 来源: 题型:填空题
(1)有下列物质 ①Cu;②液态SO2;③CH3COOH;④NaHCO3;⑤H2O;⑥熔融NaCl;⑦BaSO4 属于弱电解质的是 (填序号)
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、CO32―、OH―四种微粒的浓度由大到小的顺序为: 。NaHCO3水解的离子方程式 。
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液 的pH |
| a | 0.1 | 0.1 | pH=9 |
| b | c | 0.2 | pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫元素的含氧酸盐在工业上用途广泛,完成下列填空。
工业上用Na2SO3溶液处理工业尾气中的SO2,下表数据表示反应过程中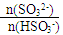 随pH变化的关系:
随pH变化的关系:
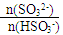 | 91:9 | 1:1 | 9:91 |
| 室温下pH | 8.2 | 7.2 | 6.2 |
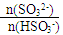 = 1时,溶液pH= 7.2的原因:___________________;若用0.20 mol/L 的NaOH溶液(反应前后溶液体积不变)吸收SO2,若反应后溶液呈中性,则
= 1时,溶液pH= 7.2的原因:___________________;若用0.20 mol/L 的NaOH溶液(反应前后溶液体积不变)吸收SO2,若反应后溶液呈中性,则查看答案和解析>>
科目:高中化学 来源: 题型:填空题
酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
回答下列问题:
(1)SnCl2用盐酸而不用水直接溶解的原因是
加入锡粉的作用是
(2)反应I生成的沉淀为SnO,写出该反应的化学方程式:
(3)检验沉淀已经“洗涤”干净的操作是: (3分)
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH。若溶液中c(Sn2+)=1.0mol·L—1,则室温下应控制溶液pH 。(已知:Ksp[Sn(OH)2]=1.0×10—26)
(5)酸性条件下,SnSO4还可用作双氧水的去除剂,试写出所发生反应的离子方程式:
。
(6)潮湿环境中,镀锡铜即使锡层破损也能防止形成铜绿,请结合有关的原理解释其原因:
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH 11(填“>”“=”或“<”),原因是 (用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH NaOH溶液的pH(填“>”“=”或“<”);
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(NH4+)由大到小的顺序为 ;
(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 性,溶液中c(Na+) c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈 性,溶液中c(Na+)
c(CH3COO-)(填“>”“=”或“<”);
(4)25℃,用0.1000 mol / LNaOH溶液滴定20.00mL0.1000mol/L某一元酸HA溶液所得滴定曲线如图。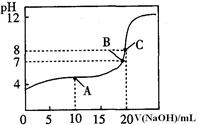
①为减小实验误差,由图可知滴定时指示剂应选用 (填“石蕊”、“酚酞”、“甲基橙”);
②A、B、C三点所示溶液导电能力最强的是 点对应的溶液;
③25OC,HA的电离平衡常数约为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1) 25℃时,部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 | Ki=1.7×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(一)(1)甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染。
已知: CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH1=―890.3 kJ/mol
2CO (g) + O2(g) = 2CO2(g) ΔH2=―566.0 kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的________倍(计算结果保留1位小数)。
(2)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol/L的氯化铜溶液的装置示意图: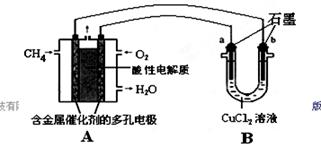
请回答:
①甲烷燃料电池的负极反应式是________。
②当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________g。
(二)下表是几种弱电解质的电离平衡常数、难溶电解质的
溶度积Ksp (25℃)。
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH CH3COO-+H+ CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3 H++HCO3- H++HCO3-HCO3-  H++CO32- H++CO32- | K1=4.31×10-7 K2=5.61×10-11 | |
| C6H5OH | C6H5OH  C6H5O-+H+ C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4 H++H2PO4- H++H2PO4-H2PO4-  H++HPO32- H++HPO32-HPO42-  H++PO43- H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| NH3·H2O | NH3·H2O NH4++OH- NH4++OH- | 1.76×10-5 | |
| BaSO4 | BaSO4 Ba2++SO42- Ba2++SO42- | | 1.07×10-10 |
| BaCO3 | BaCO3 Ba2++CO32- Ba2++CO32- | | 2.58×10-9 |
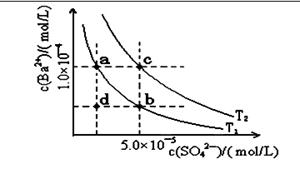
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(15分)工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)④的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com