
【题目】有关物质的转化关系如下图所示。A、C、E是常见的金属单质,E为紫红色,反应①可用于焊接铁轨,B是赤铁矿的主要成分,F的溶液中加入KSCN溶液变红。(部分反应物和生成物省略)
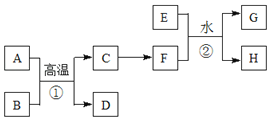
请回答下列问题:
(1)B的化学式是____________D的化学式是_____________
(2)可选用__________(填“字母”)实现反应C→F的转化。
a.稀盐酸 b.氯气/点燃 c.CuSO4溶液
(3)反应①的化学方程式为___________________________。
(4)反应②的离子方程式为___________________________。
【答案】Fe2O3 Al2O3 b 2Al+ Fe2O3![]() 2Fe + Al2O3 2Fe3+ +Cu=Cu2++2Fe2+
2Fe + Al2O3 2Fe3+ +Cu=Cu2++2Fe2+
【解析】
A、C、E是常见的金属单质,反应①可用于焊接铁轨,B是赤铁矿的主要成分,则A为Al、B为Fe2O3,C为Fe,D为Al2O3,E是紫红色的金属单质,则E为Cu,F的溶液中加入KSCN溶液变红,F为铁盐,可以由Fe与氯气反应得到,反应②为Cu+2Fe3+=Cu2++2Fe2+,据此分析解答。
根据上述分析,A为Al、B为Fe2O3,C为Fe,D为Al2O3,E为Cu,F为铁盐。
(1)B的化学式为Fe2O3,D的化学式为Al2O3,故答案为:Fe2O3;Al2O3;
(2)反应C→F是Fe转化为Fe3+,Fe与盐酸、CuSO4溶液生成Fe2+,Fe与氯气反应生成 FeCl3,故答案为:b;
(3)反应①为铝热反应,反应的化学方程式为:2Al+Fe2O3 ![]() 2Fe+Al2O3,故答案为:2Al+Fe2O3
2Fe+Al2O3,故答案为:2Al+Fe2O3 ![]() 2Fe+Al2O3;
2Fe+Al2O3;
(4)反应②为铁盐与铜的反应,反应的离子方程式为:Cu+2Fe3+=Cu2++2Fe2+,故答案为:Cu+2Fe3+=Cu2++2Fe2+。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】为了配制NH4+的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入适量( )
①浓盐酸 ②NaCl固体 ③浓氨水 ④ NaOH固体
A. ①②B. ③C. ③④D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法正确的是( )

A.a点时溶液中阳离子仅为Cu2+和Fe2+
B.b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C.c点时加入的铁粉与Cu2+反应
D.原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为工业从海水中提取液溴的流程图:
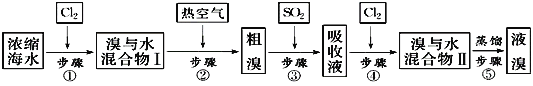
已知:溴的沸点为59℃,微溶于水,有毒性。请回答:
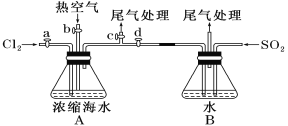
(1)某同学利用下图装置进行步骤①至步骤④的实验,当进行步骤①时,应关闭活塞___,打开活塞____。
(2)步骤②中可根据___现象,简单判断热空气的流速。
(3)步骤③中简单判断反应完全的依据是___。
(4)从“溴水混合物Ⅰ”到“溴水混合物Ⅱ”的目的是___。
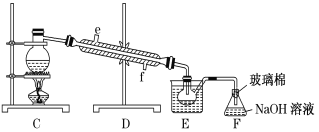
(5)步骤⑤用下图装置进行蒸馏,蒸馏烧瓶中尚未安装温度计,安装其位置时应注意___,装置C中直接加热不合理,应改为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可以从电解铜的阳极泥中提取很多重要物质,其工艺流程如下:
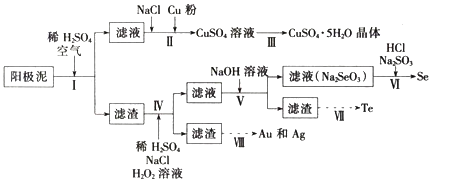
已知:①阳极泥的主要化学成分,如表所示:
主要成分 | Cu Ag Au Se Te |
百分含量/% | 23.4 12.1 0.9 6.7 3.1 |
②温度和硫酸浓度对阳极泥中各组分浸出率的影响,如表所示:
固定浸出温度 | 固定H2SO4浓度 | |||
H2SO4浓度 / mol·L-1 | 浸出率/% | 浸出温度/℃ | 浸出率/% | |
Cu Ag Au Se Te | Cu Ag Au Se Te | |||
4 | 95.1 4.67 <0.2 0.83 8.93 | 30 | 87.1 4.58 <0.2 0.08 6.83 | |
3 | 94.5 4.65 <0.2 0.28 6.90 | 40 | 94.5 4.65 <0.2 0.28 6.90 | |
2 | 78.1 2.65 <0.2 0.05 2.85 | 50 | 96.1 5.90 <0.2 0.64 8.73 |
(1)步骤I的主要目的为浸出铜,发生的主要反应的化学方程式为__________;分析表2数据,可知步骤I最适合的条件为______________。
(2)步骤II中,加入Cu粉的目的是除去滤液中含碲的离子,加入NaCl的目的为________。
(3)步骤III的操作方法为___________。
(4)步骤IV中,反应温度为75℃。加入H2O2溶液作用为______________;此过程中H2O2溶液的添加量要远远高于理论值,原因为_____________。
(5)步骤VI中所发生反应的化学方程式为_______。
(6)步骤VII中,碱性环境下电解Na2TeO3溶液可得Te实现,阴极的电极反应式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO2、CO、H2组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2、H2、CO的体积比可为( )
A. 13∶8∶29B. 22∶1∶14
C. 29∶8∶13D. 13∶16∶57
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含NaCl、MgCl2和Na2SO4的混合溶液,某兴趣小组的同学欲提取纯净的NaCl晶体,设计了如下实验:
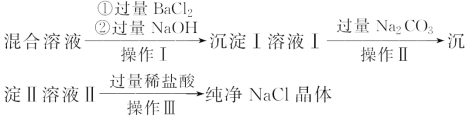
请回答下列问题:
(1)写出沉淀Ⅰ和沉淀Ⅱ所含物质的化学式。沉淀Ⅰ:_________、沉淀Ⅱ:_______。
(2)上述流程中,加入过量稀盐酸的目的是______________。
(3)操作Ⅲ中需使用的玻璃仪器是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式如如图。
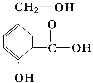
(1)请写出该物质的含氧官能团名称______、______和______。
(2)请写出以下化学反应的方程式:
①A跟NaOH溶液反应:__________
②A跟NaHCO3溶液反应:__________
③A在一定条件下跟Na反应:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-H++A2-(Ka=1.0×10-2),下列说法正确的是
A. 在0.1mol/L的H2A溶液中,c(H+)=0.2mol/L
B. 在0.1mol/L的Na2A溶液中,c(A2-)+c(HA-)+c(H2A)=0.1mol/L
C. 0.1mol/L的NaHA溶液中离子浓度为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
D. 分别将浓度均为0.1mol/L的NaHA和Na 2A溶液等体积混合,其pH一定大于7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com