
【题目】某二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-H++A2-(Ka=1.0×10-2),下列说法正确的是
A. 在0.1mol/L的H2A溶液中,c(H+)=0.2mol/L
B. 在0.1mol/L的Na2A溶液中,c(A2-)+c(HA-)+c(H2A)=0.1mol/L
C. 0.1mol/L的NaHA溶液中离子浓度为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
D. 分别将浓度均为0.1mol/L的NaHA和Na 2A溶液等体积混合,其pH一定大于7
【答案】C
【解析】
A.二元酸(H2A)在水中的电离方程式为: H2A=H++HA-,HA-H++A2-(Ka=1.0×10-2),第一步完全电离,第二步部分电离,设电离的HA-为x,则有:[x×(0.1+x)]/(0.1-x)= 1.0×10-2,解之得x=0.0084,所以在0.1mol/L的H2A溶液中,c(H+)=0.1+0.0084=0.1084mol/L,故A错误;
B.二元酸(H2A)在水中的电离方程式为: H2A=H++HA-,HA-H++A2-(Ka=1.0×10-2),可以知道第一步完全电离,第二步部分电离,则在0.1mol/L的Na2A溶液中,存在HA-和A2-离子,且c(A2-)+c(HA-)=0.1mol/L,故B错误;
C. 在0.1mol/L的NaHA溶液中,HA-会发生电离作用,所以c(Na+)>c(HA-);电离 使 溶 液 显 酸 性,c(H+)>c(OH-);但是HA-的电离作用是微弱的,而且在溶液中还存在水的电离作用,因此c(HA-)>c(H+)>c(A2-)。故溶液中的离子浓度的关系是
c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故C正确;
D. 由于在NaHA的溶液中存在HA-![]() H++ A2-(Ka=1.0×10-2)将同浓度(0.1 mol·L-1)的NaHA和Na2A溶液等体积混合,由于HA-的电离作用大于水解作用,所以其pH一定小于7,故D错误;
H++ A2-(Ka=1.0×10-2)将同浓度(0.1 mol·L-1)的NaHA和Na2A溶液等体积混合,由于HA-的电离作用大于水解作用,所以其pH一定小于7,故D错误;
故答案选C。


科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。A、C、E是常见的金属单质,E为紫红色,反应①可用于焊接铁轨,B是赤铁矿的主要成分,F的溶液中加入KSCN溶液变红。(部分反应物和生成物省略)
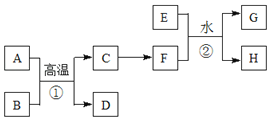
请回答下列问题:
(1)B的化学式是____________D的化学式是_____________
(2)可选用__________(填“字母”)实现反应C→F的转化。
a.稀盐酸 b.氯气/点燃 c.CuSO4溶液
(3)反应①的化学方程式为___________________________。
(4)反应②的离子方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,室温下分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2 和O2 的混合气体,若将H2、O2 的混合气体点燃引爆。活塞先左弹,恢复室温后,活塞右滑停留于容器的中央。则原来H2、O2 的物质的量之比可能为①4∶5 ② 2∶5 ③3∶8 ④7∶2
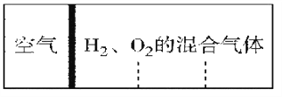
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中,只含有下表中所示的四种离子,则X离子及其个数b可能为( )
离子 | Na+ | Al3+ | Cl- | X |
个数 | 3a | 3a | 2a | b |
A.![]() 、4aB.
、4aB.![]() 、4aC.
、4aC.![]() 、8aD.
、8aD.![]() 、5a
、5a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式:________________________________________。
(2)下列三种情况下,离子方程式与 (1)相同的是_______(填序号)。
A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
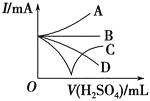
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用如图中的_______(填序号)曲线表示。
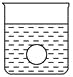
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示。向该烧杯中缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2 通入 BaCl2 溶液中并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则图中右侧 Y 形管中放置的药品组合符合要求的是( )
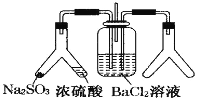
①Cu 和浓硝酸 ②CaO 和浓氨水 ③大理石和稀盐酸④高锰酸钾溶液和浓盐酸 ⑤过氧化钠和水 ⑥过氧化氢和二氧化锰
A. 全部B. ③⑤C. ①②⑤⑥D. ①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁(26Fe)、钴(27Co)两种元素均为第四周期元素,它们的用途极为广泛。回答:
(1)26Fe位于元素周期表的第______纵行。
(2)为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的催化效果,某研究小组进行了如下探究:
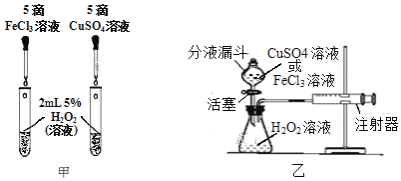
①如图甲,可通过观察______来定性比较两者的催化效果。
②如图乙,要定量比较两者的催化效果,可测量生成等体积气体所需的______。
③在FeCl3溶液中,究竟是哪种粒子起催化作用?
猜想1:铁离子(Fe3+)起催化作用;
猜想2:______起催化作用;猜想3:______起催化作用;……
若要验证猜想1成立,只需要在图甲的两只试管中分别加入同浓度、同体积的______和______,再通过观察现象,即可证明猜想1成立。
(3)请仔细阅读、分析下列有关利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程图,回答下列问题:
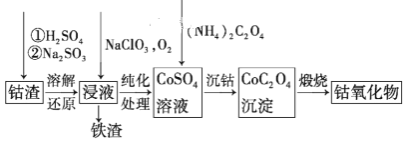
铁渣中铁元素的化合价为______,在空气中煅烧CoC2O4(草酸钴,其中碳为+3价),生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2H2(g)+O2(g)=2H2O(l)△H=﹣483.6 kJmol﹣1,则氢气的燃烧热为483.6 kJmol﹣1
B. 在一定温度和压强下,将0.5mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放出热量19.3 kJ,则其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=﹣19.3kJ/mol
2NH3(g) △H=﹣19.3kJ/mol
C. 已知2C(s)+2O2(g)=2CO2(g)△H1 2C(s)+O2(g)=2CO(g)△H2 则△H1>△H2
D. 已知Ni(CO)4(s)=Ni(s)+4CO(g) △H=Q kJmol﹣1,则Ni(s)+4CO(g)=Ni(CO)4(s) △H=﹣Q kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某化学小组用实验的方法进行探究。
I.探究活动一:
备选药品:铁片、锌片、0.5mol/LH2SO4、1.5mol/LH2SO4、18.4mol/LH2SO4
甲同学研究的实验报告
实验步骤 | 现象 | 结论 |
①分别取等体积的1.5mol/L的硫酸于两支试管中; ②_____________________。 | 反应速率: 锌>铁 | 金属的性质越活泼,反应速率越快 |
(1)甲同学实验报告中的实验步骤②为__________________________________。
(2)甲同学的实验目的是_______________________________;要得出正确的实验结论,还需控制的实验条件是__________________。
乙同学为了定量研究浓度对化学反应速率的影响,利用如图所示装置进行实验:

(3)乙同学在实验中需要测定的数据是_________________________。
(4)乙同学不会选用___________mol/L硫酸完成该实验,理由是_________________。
II.探究活动二:
备选药品:0.1mol/LNa2S2O3溶液、0.2mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、0.2mol/LH2SO4溶液。
已知:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
实验 编号 | Na2S2O3用量 | H2SO4用量 | 温度(℃) |
① | 0.1mol/L5mL | 0.1mol/L5mL | 10 |
② | 0.2mol/L5mL | 0.2mol/L5mL | 25 |
③ | 0.1mol/L5mL | 0.1mol/L5mL | 25 |
④ | 0.1mol/L5mL | 0.1mol/L5mL | 40 |
(1)若想探究温度对化学反应速率的影响,可选的实验编号有___________。
(2)若想探究浓度对化学反应速率的影响,可选的实验编号有___________。
(3)在该实验过程中,需要观察和记录________________,来比较化学反应速率的快慢。
(4)Na2S2O3在碱性溶液中可被I2氧化为Na2SO4,写出该反应的离子方程式___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com