
【题目】向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式:________________________________________。
(2)下列三种情况下,离子方程式与 (1)相同的是_______(填序号)。
A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
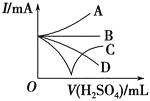
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用如图中的_______(填序号)曲线表示。
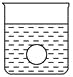
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示。向该烧杯中缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将_______。
【答案】Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O A C 下沉
【解析】
(1)向Ba(OH)2溶液中逐滴加入稀硫酸,反应的离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O。(2)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液显中性,反应的离子方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀,离子方程式为:Ba2++OH-+SO42-+H+=BaSO4↓+H2O;向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量,反应的离子方程式为:H++SO42-+Ba2++OH-=BaSO4↓+H2O。(3)向Ba(OH)2溶液中缓缓加入稀硫酸,当Ba(OH)2与H2SO4恰好完全反应时,溶液导电能力接近为零,再加过量稀硫酸,溶液导电能力又增强,故曲线C正确。(4)Ba(OH)2与H2SO4反应过程中,随反应的进行,溶液密度变小,塑料小球下沉。


科目:高中化学 来源: 题型:
【题目】工业上可以从电解铜的阳极泥中提取很多重要物质,其工艺流程如下:
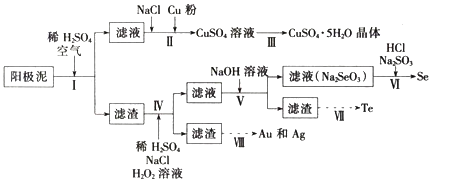
已知:①阳极泥的主要化学成分,如表所示:
主要成分 | Cu Ag Au Se Te |
百分含量/% | 23.4 12.1 0.9 6.7 3.1 |
②温度和硫酸浓度对阳极泥中各组分浸出率的影响,如表所示:
固定浸出温度 | 固定H2SO4浓度 | |||
H2SO4浓度 / mol·L-1 | 浸出率/% | 浸出温度/℃ | 浸出率/% | |
Cu Ag Au Se Te | Cu Ag Au Se Te | |||
4 | 95.1 4.67 <0.2 0.83 8.93 | 30 | 87.1 4.58 <0.2 0.08 6.83 | |
3 | 94.5 4.65 <0.2 0.28 6.90 | 40 | 94.5 4.65 <0.2 0.28 6.90 | |
2 | 78.1 2.65 <0.2 0.05 2.85 | 50 | 96.1 5.90 <0.2 0.64 8.73 |
(1)步骤I的主要目的为浸出铜,发生的主要反应的化学方程式为__________;分析表2数据,可知步骤I最适合的条件为______________。
(2)步骤II中,加入Cu粉的目的是除去滤液中含碲的离子,加入NaCl的目的为________。
(3)步骤III的操作方法为___________。
(4)步骤IV中,反应温度为75℃。加入H2O2溶液作用为______________;此过程中H2O2溶液的添加量要远远高于理论值,原因为_____________。
(5)步骤VI中所发生反应的化学方程式为_______。
(6)步骤VII中,碱性环境下电解Na2TeO3溶液可得Te实现,阴极的电极反应式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列有机物的结构简式,若有违反系统命名者请予以纠正。
(1)3,5-二甲基己烷________________,正确名称:________________
(2)3,3,4,4-四甲基-2-乙基戊烷________________,正确名称:________________
(3)4,4,5,5-四甲基-3-丙基己烷________________,正确名称:________________
(4)2,3,4,5-四甲基-3-乙基-5-丙基庚烷____________,正确名称:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置。
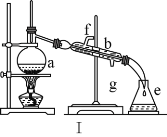
(1)写出下列仪器的名称:a.____,b._____,c.____。
(2)仪器ae中,使用前必须检查是否漏水的有____(填序号)。
(3)若利用装置Ⅰ分离四氯化碳和酒精的混合物,温度计水银球的位置在____处。冷凝水由(填“f”或“g”,下同)____口通入,_____口流出。
(4)现需配制0.13mol·L1NaOH溶液450mL,装置Ⅱ是某同学转移溶液的示意图。
①根据计算用托盘天平称取NaOH溶液的质量为_____g。为完成此溶液配制实验需要的玻璃仪器有______。
②图Ⅱ中的错误是_____。
③配制时,按以下几个步骤进行:计算、称量、溶解、冷却、转移、定容、摇匀、装瓶。操作中还缺少一个重要步骤是_____。
④取用任意体积的该NaOH溶液时,下列物理量中不随所取体积的多少而变化的是_____(填字母)。
A.溶液中Na的物质的量 B.溶液的浓度
C.NaOH的溶解度 D.溶液的密度
⑤下面操作造成所配NaOH溶液浓度偏高的是_____。
A.暴露在空气中称量NaOH的时间太长
B.将砝码放在左盘上, NaOH放在右盘上进行称量(使用游码)
C.向容量瓶转移液体时,容量瓶内含有蒸馏水
D.溶解后未冷却至室温就转移至容量瓶
E.转移液体时玻璃棒的下端放在容量瓶刻度线以上处
F.定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
G.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。
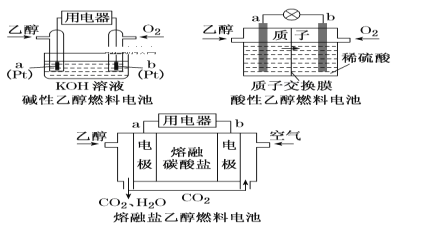
①三种乙醇燃料电池中正极反应物均为______________________;
②碱性乙醇燃料电池中,电极a上发生的电极反应式为_______________________________;
③熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,电极b上发生的电极反应式为________。
(2)天然气既是高效洁净的能源,也是重要的化工原料。
①甲烷与氯气光照条件下的产物有多种,其中三氯甲烷(氯仿)可用作麻醉剂。氯仿分子的空间构型为_______________。
②甲烷高温分解生成氢气和炭黑。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-H++A2-(Ka=1.0×10-2),下列说法正确的是
A. 在0.1mol/L的H2A溶液中,c(H+)=0.2mol/L
B. 在0.1mol/L的Na2A溶液中,c(A2-)+c(HA-)+c(H2A)=0.1mol/L
C. 0.1mol/L的NaHA溶液中离子浓度为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
D. 分别将浓度均为0.1mol/L的NaHA和Na 2A溶液等体积混合,其pH一定大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用AG表示溶液的酸碱度,AG=![]() 。25℃,用0.100mol·L-1NaOH液滴定20.00 mL 0.100 mol·L-1 HNO2溶液, AG与所加NaOH溶液的体积(V)关系如图所示。下列说法不正确的是
。25℃,用0.100mol·L-1NaOH液滴定20.00 mL 0.100 mol·L-1 HNO2溶液, AG与所加NaOH溶液的体积(V)关系如图所示。下列说法不正确的是

A. D点溶液中的pH=11.25
B. B点溶液中存在2c(H+)-2c(OH-)=c(NO2-)-c(HNO2)
C. C点时,加入NaOH溶液的体积小于20.00 mL
D. 25℃时,HNO2的电离平衡常数Ka=1.0×10-5.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】压强变化不会使下列化学反应的平衡发生移动的是( )
A. C(s)+CO2(g)![]() 2CO(g)B. 3H2(g)+N2(g)
2CO(g)B. 3H2(g)+N2(g)![]() 2NH3(g)
2NH3(g)
C. 2SO2(g)+O2(g)![]() 2SO3(g)D. H2(g)+I2(g)
2SO3(g)D. H2(g)+I2(g)![]() 2HI(g)
2HI(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(气)+3B(气)![]() 2C(气)+2D(固)达到平衡的标志的是( )
2C(气)+2D(固)达到平衡的标志的是( )
①C的生成速率与C的分解速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④A、B、C的分压强不再变化
⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化
⑦A、B、C、D的分子数之比为1:3:2:2
A.②⑦B.②⑤⑦C.①③④D.②⑤⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com