
【题目】在一定温度下,下列叙述不是可逆反应A(气)+3B(气)![]() 2C(气)+2D(固)达到平衡的标志的是( )
2C(气)+2D(固)达到平衡的标志的是( )
①C的生成速率与C的分解速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④A、B、C的分压强不再变化
⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化
⑦A、B、C、D的分子数之比为1:3:2:2
A.②⑦B.②⑤⑦C.①③④D.②⑤⑥⑦
【答案】A
【解析】
可逆反应A(气)+3B(气)2C(气)+2D(固)达到平衡状态,一定满足正逆反应速率相等,反应体系中各组分的浓度不再变化;注意生成物D是固体,反应两边气体的质量不相等,据此进行判断。
①C的生成速率与C的分解速率相等,说明正逆反应速率相等,该反应达到了化学平衡状态,故①不选;
②单位时间内生成amolA,同时生成3amolB,表示的都是逆反应速率,无法判断正逆反应速率是否相等,无法判断是否达到了平衡状态,故②选;
③A、B、C的浓度不再变化,说明正逆反应速率相等,反应达到了平衡状态,故③不选;
④A、B、C的分压强不再变化,反应方程式两边气体的体积不相等,压强不变,说明正逆反应速率相等,达到了平衡状态,故④不选;
⑤混合气体的总压强不再变化,反应方程式两边气体的化学计量数之和不相等,总压强不再变化,说明各组分的浓度不变,正逆反应速率相等,达到了平衡状态,故⑤不选;
⑥反应两边气体的体积不相同,混合气体的物质的量是个变化的量,混合气体的物质的量不再变化,说明正逆反应速率相等,达到了平衡状态,故⑥不选;
⑦单位时间内消耗amolA,同时生成 3amolB,说明正逆反应速率相等,各组分的浓度不再变化,达到了平衡状态,故⑦不选;
⑧A、B、C、D的分子数之比为1:3:2:2,不能判断各组分的分子数是否不再变化,无法判断是否达到平衡状态,故⑧选;
故答案为A。


科目:高中化学 来源: 题型:
【题目】向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式:________________________________________。
(2)下列三种情况下,离子方程式与 (1)相同的是_______(填序号)。
A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用如图中的_______(填序号)曲线表示。
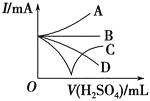
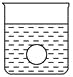
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示。向该烧杯中缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气。
I.工业上通常采用电解法制氯气:观察下图,回答:
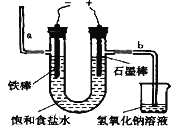
(1)通电后,_____(填“铁棒”或“石墨棒”)电极上产生氯气,若饱和食盐水中含有酚酞,______(填“a”或“b”)侧先变红。
(2)写出该电解反应的化学方程式为_______________________________________。
(3)该装置中,NaOH溶液的作用是____________________________。
II.在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图:

(1)连接上述仪器的正确顺序是:E→_______→________→_______→_______→H→G→F。
(2)气体发生装置中进行的反应化学方程式是________________________________;若在标准状态下收集到4.48 L氯气,则被氧化的HCl的物质的量是_______mol。
(3)上面装置中饱和食盐水的作用是__________________。
(4)将新制氯水滴到pH试纸上,现象为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于在一个密闭容器中进行的反应C(s)+H2O(g) ![]() CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
①增加C的量; ②增加CO的量;
③将容器的体积缩小一半; ④保持体积不变,充入N2以增大压强;
⑤升高反应体系的温度; ⑥保持压强不变,充入N2以增大体积。
A. ②③ B. ①④ C. ①⑥ D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为达到预期的实验目的,下列操作中正确的有( )
①配制FeCl3溶液时,将FeCl3固体溶于盐酸中,然后再用水稀释到所需的浓度
②用10 mL的量筒量取4.80 mL的浓硫酸
③蒸发溶液时,边加热边搅拌,直至蒸发皿中的液体蒸干
④向无色溶液中加入BaCl2溶液,生成白色沉淀,再加稀硝酸,沉淀不消失,由此确定该溶液中一定含有SO![]()
⑤为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
⑥中和热测定的实验中使用的玻璃仪器只有2种
⑦实验室可利用浓氨水和碱石灰混合的方法制取少量氨气
⑧除去NO中混有的NO2气体可通过水洗,再干燥后用向上排空气法收集
A. 5项 B. 4项
C. 3项 D. 2项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某化学小组用实验的方法进行探究。
I.探究活动一:
备选药品:铁片、锌片、0.5mol/LH2SO4、1.5mol/LH2SO4、18.4mol/LH2SO4
甲同学研究的实验报告
实验步骤 | 现象 | 结论 |
①分别取等体积的1.5mol/L的硫酸于两支试管中; ②_____________________。 | 反应速率: 锌>铁 | 金属的性质越活泼,反应速率越快 |
(1)甲同学实验报告中的实验步骤②为__________________________________。
(2)甲同学的实验目的是_______________________________;要得出正确的实验结论,还需控制的实验条件是__________________。
乙同学为了定量研究浓度对化学反应速率的影响,利用如图所示装置进行实验:

(3)乙同学在实验中需要测定的数据是_________________________。
(4)乙同学不会选用___________mol/L硫酸完成该实验,理由是_________________。
II.探究活动二:
备选药品:0.1mol/LNa2S2O3溶液、0.2mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、0.2mol/LH2SO4溶液。
已知:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
实验 编号 | Na2S2O3用量 | H2SO4用量 | 温度(℃) |
① | 0.1mol/L5mL | 0.1mol/L5mL | 10 |
② | 0.2mol/L5mL | 0.2mol/L5mL | 25 |
③ | 0.1mol/L5mL | 0.1mol/L5mL | 25 |
④ | 0.1mol/L5mL | 0.1mol/L5mL | 40 |
(1)若想探究温度对化学反应速率的影响,可选的实验编号有___________。
(2)若想探究浓度对化学反应速率的影响,可选的实验编号有___________。
(3)在该实验过程中,需要观察和记录________________,来比较化学反应速率的快慢。
(4)Na2S2O3在碱性溶液中可被I2氧化为Na2SO4,写出该反应的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Cl2=2Cl﹣+2Fe3+,2Br﹣+Cl2=Br2+2Cl﹣,2Fe2++Br2=2Br﹣+2Fe3+。在bL FeBr2溶液中通入amol Cl2时,使溶液中50% 的Br﹣氧化为Br2,则原FeBr2的物质的量浓度为
A. a/bmolL﹣1 B. 2a/bmolL﹣1 C. 3a/bmolL﹣1 D. 5a/bmolL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):

下列说法不正确的是
A. HAP能提高HCHO与O2的反应速率
B. HCHO在反应过程中,有C-H键发生断裂
C. 根据图示信息,CO2分子中的氧原子全部来自O2
D. 该反应可表示为:HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石油裂化和裂解过程得到的乙烯、丙烯来合成丙烯酸乙酯的路线如图:
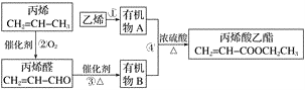
根据以上材料和你所学的化学知识,回答下列问题:
(1)乙烯的电子式是_____,官能团的名称是______。
(2)除去甲烷中的乙烯所用的试剂是____(填序号)。
A.稀硫酸
B.溴的四氯化碳溶液
C.水
D.酸性高锰酸钾溶液
(3)反应①的化学方程式是______,反应类型是_____。
(4)反应④的化学方程式是______,反应类型是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com