
【题目】铁(26Fe)、钴(27Co)两种元素均为第四周期元素,它们的用途极为广泛。回答:
(1)26Fe位于元素周期表的第______纵行。
(2)为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的催化效果,某研究小组进行了如下探究:
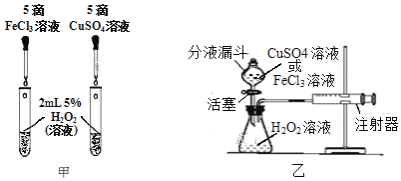
①如图甲,可通过观察______来定性比较两者的催化效果。
②如图乙,要定量比较两者的催化效果,可测量生成等体积气体所需的______。
③在FeCl3溶液中,究竟是哪种粒子起催化作用?
猜想1:铁离子(Fe3+)起催化作用;
猜想2:______起催化作用;猜想3:______起催化作用;……
若要验证猜想1成立,只需要在图甲的两只试管中分别加入同浓度、同体积的______和______,再通过观察现象,即可证明猜想1成立。
(3)请仔细阅读、分析下列有关利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程图,回答下列问题:
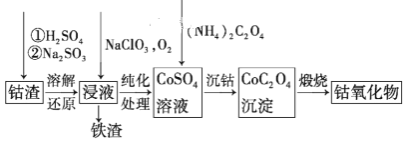
铁渣中铁元素的化合价为______,在空气中煅烧CoC2O4(草酸钴,其中碳为+3价),生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为______。
【答案】四 产生气泡的速率 时间 氯离子(Cl-) 水分子(H2O) FeCl3溶液 AlCl3溶液 +3 Co3O4
【解析】
(1)根据核外电子排布规律分析解答;
(2)根据影响反应速率的因素分析解答;
(3)由制备流程可知,加硫酸溶解后为铁离子,再与亚硫酸钠发生氧化还原反应生成亚铁离子,在浸液中通入氧气时亚铁离子被氧化为铁离子;煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),n(CO2)=![]() =0.06mol,由化学式可知n(Co)=0.06mol×
=0.06mol,由化学式可知n(Co)=0.06mol×![]() =0.03mol,则氧化物中n(O)=
=0.03mol,则氧化物中n(O)=![]() =0.04mol,以此来解答。
=0.04mol,以此来解答。
(1)Fe的原子结构示意图为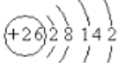 ,则Fe元素位于元素周期表的第四纵行,故答案为:四;
,则Fe元素位于元素周期表的第四纵行,故答案为:四;
(2)①比较两种物质对过氧化氢分解速率的影响,可以观察二者产生气泡的速率,故答案为:产生气泡的速率;
②催化剂的催化效果越好,反应产生气体的速率越快,可通过测量产生等体积的氧气所需要的时间来分析,所需时间越短,催化效果越好,故答案为:时间;
③氯化铁溶液中存在铁离子、氯离子和水分子,故猜想可能是铁离子或氯离子或水分子所起的催化作用;检验是否是铁离子所起的催化作用,只需要在图甲的两只试管中分别加入同浓度、同体积的FeCl3溶液和AlCl3溶液,通过观察现象,即可证明,故答案为:氯离子(Cl-);水分子(H2O);FeCl3溶液;AlCl3溶液;
(3)由制备流程可知,加硫酸溶解后为铁离子,再与亚硫酸钠发生氧化还原反应生成亚铁离子,在浸液中通入氧气时亚铁离子被氧化为铁离子,可知铁渣中铁元素的化合价为+3价;煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),n(CO2)=![]() =0.06mol,由化学式可知n(Co)=0.06mol×
=0.06mol,由化学式可知n(Co)=0.06mol×![]() =0.03mol,则氧化物中n(O)=
=0.03mol,则氧化物中n(O)=![]() =0.04mol,则n(Co):n(O)=0.03mol:0.04mol=3:4,所以钴氧化物的化学式为Co3O4,故答案为:+3;Co3O4。
=0.04mol,则n(Co):n(O)=0.03mol:0.04mol=3:4,所以钴氧化物的化学式为Co3O4,故答案为:+3;Co3O4。
本题考查实验装置的综合应用,为高频考点,把握反应速率测定原理及影响反应速率的因素为解答的关键,侧重分析与实验能力的考查,(3)中化学式的计算为解答的难点,题目难度适中。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】现有含NaCl、MgCl2和Na2SO4的混合溶液,某兴趣小组的同学欲提取纯净的NaCl晶体,设计了如下实验:
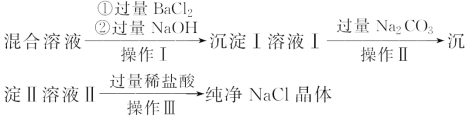
请回答下列问题:
(1)写出沉淀Ⅰ和沉淀Ⅱ所含物质的化学式。沉淀Ⅰ:_________、沉淀Ⅱ:_______。
(2)上述流程中,加入过量稀盐酸的目的是______________。
(3)操作Ⅲ中需使用的玻璃仪器是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置。
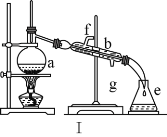
(1)写出下列仪器的名称:a.____,b._____,c.____。
(2)仪器ae中,使用前必须检查是否漏水的有____(填序号)。
(3)若利用装置Ⅰ分离四氯化碳和酒精的混合物,温度计水银球的位置在____处。冷凝水由(填“f”或“g”,下同)____口通入,_____口流出。
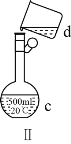
(4)现需配制0.13mol·L1NaOH溶液450mL,装置Ⅱ是某同学转移溶液的示意图。
①根据计算用托盘天平称取NaOH溶液的质量为_____g。为完成此溶液配制实验需要的玻璃仪器有______。
②图Ⅱ中的错误是_____。
③配制时,按以下几个步骤进行:计算、称量、溶解、冷却、转移、定容、摇匀、装瓶。操作中还缺少一个重要步骤是_____。
④取用任意体积的该NaOH溶液时,下列物理量中不随所取体积的多少而变化的是_____(填字母)。
A.溶液中Na的物质的量 B.溶液的浓度
C.NaOH的溶解度 D.溶液的密度
⑤下面操作造成所配NaOH溶液浓度偏高的是_____。
A.暴露在空气中称量NaOH的时间太长
B.将砝码放在左盘上, NaOH放在右盘上进行称量(使用游码)
C.向容量瓶转移液体时,容量瓶内含有蒸馏水
D.溶解后未冷却至室温就转移至容量瓶
E.转移液体时玻璃棒的下端放在容量瓶刻度线以上处
F.定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
G.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-H++A2-(Ka=1.0×10-2),下列说法正确的是
A. 在0.1mol/L的H2A溶液中,c(H+)=0.2mol/L
B. 在0.1mol/L的Na2A溶液中,c(A2-)+c(HA-)+c(H2A)=0.1mol/L
C. 0.1mol/L的NaHA溶液中离子浓度为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
D. 分别将浓度均为0.1mol/L的NaHA和Na 2A溶液等体积混合,其pH一定大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用AG表示溶液的酸碱度,AG=![]() 。25℃,用0.100mol·L-1NaOH液滴定20.00 mL 0.100 mol·L-1 HNO2溶液, AG与所加NaOH溶液的体积(V)关系如图所示。下列说法不正确的是
。25℃,用0.100mol·L-1NaOH液滴定20.00 mL 0.100 mol·L-1 HNO2溶液, AG与所加NaOH溶液的体积(V)关系如图所示。下列说法不正确的是

A. D点溶液中的pH=11.25
B. B点溶液中存在2c(H+)-2c(OH-)=c(NO2-)-c(HNO2)
C. C点时,加入NaOH溶液的体积小于20.00 mL
D. 25℃时,HNO2的电离平衡常数Ka=1.0×10-5.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列说法不正确的是_____________(填字母代码)。
A.对于Al(OH)3(s) |
B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的 |
C.能源、信息与材料通常被称为现代社会发展的三大支柱 |
D.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 |
E.除去硬水中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2溶解度比 MgCO3的小
II.向含有AgI的饱和溶液中:
(1)加入固体AgNO3,则c(I-)________(填“变大”、“变小”或“不变”,下同)。
(2)若改加更多的AgI,则c(Ag+)___________。
(3)若改加AgCl固体,则c(I-)___________,而c(Ag+)___________。
III.用“>”、“<”或“=”填空:
(1)25℃时1mol/L FeCl3溶液的pH______80℃时1mol/L FeCl3溶液的pH。
(2)已知NaHSO3溶液中c(HSO3-)>c(SO32-)>c(H2SO3),则溶液中c(H+)______c(OH-)。
(3)常温下,取等物质的量浓度的HA溶液与NaOH溶液等体积混合,测得混合溶液的pH=8,混合溶液中由水电离出的c(H+)水______NaOH溶液中由水电离出的c(H+)水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】压强变化不会使下列化学反应的平衡发生移动的是( )
A. C(s)+CO2(g)![]() 2CO(g)B. 3H2(g)+N2(g)
2CO(g)B. 3H2(g)+N2(g)![]() 2NH3(g)
2NH3(g)
C. 2SO2(g)+O2(g)![]() 2SO3(g)D. H2(g)+I2(g)
2SO3(g)D. H2(g)+I2(g)![]() 2HI(g)
2HI(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水杨酸是一种用途极广的消毒防腐剂及医疗保养品,是合成众多药物的中间产物,其工业合成的路线之一如下图所示:

已知:RCH=CHR1 RCOOH+R1COOH
RCOOH+R1COOH
请回答下列问题:
(1)B分子中含氧官能团的名称为_________,D→水杨酸的反应类型为_________。
(2)C转化为D的同时还有一种有机物生成,该物质的结构简式为__________,上述转化过程中B→C的意义是_________;在适当条件下,水杨酸可发生聚合反应生成一种高分子化合物,该化合物的结构简式为__________。
(3)A→B的化学方程式_________。
(4)D有多种同分异构体,符合下列条件的同分异构体最多有_________种,写出核磁共振氢谱有4个峰的物质的结构简式____________。
①是苯的二元取代物;②能发生水解反应及银镜反应
(5)以1,4-二氯丁烷为基本原料制备乙二酸,写出相应的合成路线图(格式为反应物![]() 生成物) ____________
生成物) ____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑龙江省作为我国粮食大省,对国家的粮食供应做出了突出贡献。农作物区有很多废弃秸秆(含多糖类物质),直接燃烧会加重雾霾,故秸秆的综合利用具有重要的意义。下面是以秸秆为原料合成聚酯类高分子化合物的路线:
回答下列问题:
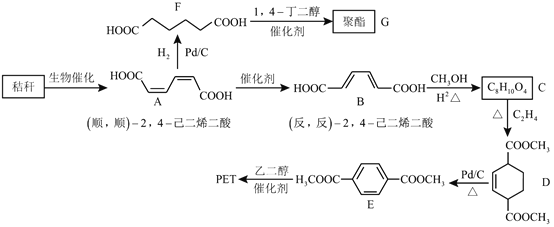
(1)下列关于糖类的说法正确的是__________。(填字母)
a.糖类都有甜味,具有![]() 的通式
的通式
b.麦芽糖水解生成互为同分异构体的葡萄糖和果糖
c.用银镜反应不能判断淀粉水解是否完全
d.淀粉和纤维素都属于多糖类天然高分子化合物
(2)B生成C的反应类型为__________。
(3)D中的官能团名称为__________,D生成E的反应类型为__________。
(4)F的化学名称是__________,由F生成G的化学方程式为__________。
(5)具有一种官能团的二取代芳香化合物W是E的同分异构体,![]() W与足量碳酸氢钠溶液反应生成1mol
W与足量碳酸氢钠溶液反应生成1mol![]() ,W共有__________种(不含立体异构),其中核磁共振氢谱为三组峰的结构简式为__________。
,W共有__________种(不含立体异构),其中核磁共振氢谱为三组峰的结构简式为__________。
(6)参照上述合成路线,以![]() ,
,![]() 和
和![]() 为原料(无机试剂任选),设计制备对苯二甲酸的合成路线________________________________________。(请用流程图表示)
为原料(无机试剂任选),设计制备对苯二甲酸的合成路线________________________________________。(请用流程图表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com