
| KMnO4酸性溶液的浓度/mol?L-1[学|科| | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
| 实验编号 | 20℃下,试管中所加试剂及其用量/mL | 20℃下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
| 4 | 4.0 | 1.0 | 3.0 | 2.0 | 4.0 |
| 5 | 2.5 | 2.5 | 3.0 | 2.0 | 4.0 |
| 0.001mol?L-1×0.004L |
| 0.004L+0.002L |
| 6min+7min+7min |
| 3 |
| △c |
| △t |
| 0.001mol/L×0.004L |
| 0.004L+0.002L |
| (6+7+7)min |
| 3 |
| △c |
| △t |
| 0.00067mol/L |
| 6.7min |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O即不是氧化产物也不是还原产物 |
| B、N2H4作氧化剂 |
| C、属于置换反应 |
| D、有单质生成的反应一定属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液稳定,胶体和浊液都不稳定 |
| B、溶液中的分散质能通过滤纸但不能通过半透膜 |
| C、溶液和胶体的本质区别在于是否能产生丁达尔效应 |
| D、NaCl溶液和CaCO3悬浊液的本质区别是分散质粒子的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
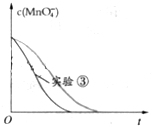 Ⅰ某化学探究小组用H2C2O4(草酸)溶液测定KMnO4溶液的浓度.请回答下列问题:取20.00mL0.2500mol/LH2C2O4标准溶液置于锥形瓶中,加入适量稀硫酸酸化,用KMnO4溶液进行滴定.滴定反应方程式为(未配平):KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O
Ⅰ某化学探究小组用H2C2O4(草酸)溶液测定KMnO4溶液的浓度.请回答下列问题:取20.00mL0.2500mol/LH2C2O4标准溶液置于锥形瓶中,加入适量稀硫酸酸化,用KMnO4溶液进行滴定.滴定反应方程式为(未配平):KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O| 滴定次数 | 标准溶液体积/mL | 待测溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 20.00 | 1.50 | 23.70 |
| 2 | 20.00 | 1.02 | 21.03 |
| 3 | 20.00 | 2.00 | 21.99 |
| 实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 | ||
| 浓度 (mol?L-1) | 体积 (mL) | 浓度 (mol?L-1) | 体积 (mL) | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
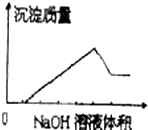 在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子可能是( )
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子可能是( )| A、Mg2+、Al3+、Fe3+ |
| B、Na+、Mg2+、Al3+ |
| C、H+、Ba2+、Al3+ |
| D、H+、Mg2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com