
【题目】如图是一个甲烷燃料电池工作时的示意图.M、N两电极的质量相同,其中一个为银电极一个为铁电极.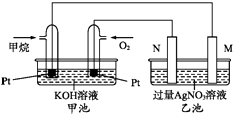
(1)写出通入甲烷的铂电极上的电极反应式为 .
(2)若一段时间后M与N两电极的总质量不变,则N电极是 . 此时两电极质量差为5.4g,甲池中理论上消耗氧气mL(标准状况)
(3)若一段时间后M与N两电极的总质量增加4g,N电极质量变化为克.
【答案】
(1)CH4﹣8e﹣+10OH﹣=CO ![]() +7H2O
+7H2O
(2)Ag;140
(3)1.4
【解析】解:碱性甲烷燃料电池中通入甲烷的一极为原电池的负极,负极上甲烷失电子发生氧化反应,电极反应式为CH4﹣8e﹣+10OH﹣=CO ![]() +7H2O,通入氧气的一极为原电池的正极,乙池为电解池,乙池中的两个电极一个是Ag电极,一个是铁电极,工作时M、N两个电极的质量都不减少,N连接原电池的正极,应为电解池的阳极,则应为Ag,N为阳极,电极反应式是Ag﹣e﹣=Ag+ , M为阴极,电极材料是Fe,电极反应式为Ag++e﹣=Ag,则乙池的总反应式为4AgNO3+2H2O
+7H2O,通入氧气的一极为原电池的正极,乙池为电解池,乙池中的两个电极一个是Ag电极,一个是铁电极,工作时M、N两个电极的质量都不减少,N连接原电池的正极,应为电解池的阳极,则应为Ag,N为阳极,电极反应式是Ag﹣e﹣=Ag+ , M为阴极,电极材料是Fe,电极反应式为Ag++e﹣=Ag,则乙池的总反应式为4AgNO3+2H2O ![]() 4Ag↓+O2↑+4HNO3 , (1)通入甲烷的铂电极上的电极反应式为CH4﹣8e﹣+10OH﹣=CO
4Ag↓+O2↑+4HNO3 , (1)通入甲烷的铂电极上的电极反应式为CH4﹣8e﹣+10OH﹣=CO ![]() +7H2O,所以答案是:CH4﹣8e﹣+10OH﹣=CO
+7H2O,所以答案是:CH4﹣8e﹣+10OH﹣=CO ![]() +7H2O;(2)一段时间后M与N两电极的总质量不变,Ag为阳极,Fe为阴极,此时两电极质量差为5.4g,n(Ag)=
+7H2O;(2)一段时间后M与N两电极的总质量不变,Ag为阳极,Fe为阴极,此时两电极质量差为5.4g,n(Ag)= ![]() =0.05mol,阳极Ag溶解,阴极Ag析出,根据Ag++e﹣=Ag可知转移电子为0.025mol,甲池中通入氧气的一极为正极,反应式为2O2+8H++8e﹣=4H2O,则消耗n(O2)=
=0.05mol,阳极Ag溶解,阴极Ag析出,根据Ag++e﹣=Ag可知转移电子为0.025mol,甲池中通入氧气的一极为正极,反应式为2O2+8H++8e﹣=4H2O,则消耗n(O2)= ![]() ×0.025mol=0.00625mol, V(O2)=0.00625mol×22.4L/mol=0.14L=140mL,
×0.025mol=0.00625mol, V(O2)=0.00625mol×22.4L/mol=0.14L=140mL,
所以答案是:Ag;140;(3)一段时间后M与N两电极的总质量增加4g,Fe为阳极,Ag为阴极,由Fe+2Ag+=Fe2++2Ag可知,
Fe+2Ag+=Fe2++2Ag△m
56 216 160
x 4g
x= ![]() =1.4g,
=1.4g,
所以答案是:1.4.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业冶炼钛的第一步反应为:TiO2(s)+2C(s)+2Cl2 ![]() TiCl4(g)+2CO.下列关于该反应的说法正确的是( )
TiCl4(g)+2CO.下列关于该反应的说法正确的是( )
A.TiCl4既是氧化产物又是还原产物
B.氧化剂与还原剂的物质的量之比为1:1
C.当转移电子数目为0.2NA时,气体体积增大1.12L
D.当有26g固体参加反应时,转移电子数目为NA .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2﹣CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛.下列叙述正确的是( ) 
A.阳极产生的气体为氟气
B.阳极区放出的气体只是纯氧气
C.TiO2在阴极表面放电
D.制备金属钛前后,CaO的总量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某溶液中加入BaCl2溶液,再加入稀硝酸,产生的白色沉淀不消失,下列叙述正确的是( )
A.溶液中一定含有SO42﹣
B.溶液中一定含有Ag+
C.溶液中一定含有SO32﹣
D.溶液中可能含有SO42﹣、SO32﹣、Ag+中的某一种、两种或三种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明氯酸钾晶体中含有氯元素,选用下面给出的试剂和操作进行验证。其操作顺序正确的是
①滴加AgNO3溶液 ②加水溶解 ③过滤、取滤液 ④与二氧化锰混合加热 ⑤加稀硝酸 ⑥与浓盐酸反应 ⑦与NaOH溶液混合加热 ⑧用淀粉KI试纸检验
A.⑥⑦①⑤ B.⑥⑧ C.④②③①⑤ D.②①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列涉及有机化合物的分离提纯的说法正确的是( )
A.除去乙烷中混有的乙烯,可将混合气体通过酸性高锰酸钾溶液
B.甲烷、乙烯和苯在工业上都可通过石油分馏得到
C.除去溴苯中混有的Br2 , 可用NaOH溶液洗涤分液
D.乙酸乙酯中的少量乙酸和乙醇可用氢氧化钠溶液除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硫酸的化学事实与硫酸表现出的性质(括号中)的描述中,不正确的是
A.久置在敞口容器中的浓硫酸,溶液质量增大(吸水性)
B.在加热条件下铁与浓硫酸反应(氧化性、酸性)
C.蔗糖与浓硫酸反应的“黑面包”实验(吸水性)
D.浓硫酸与氯化钠固体反应制HCl(难挥发性)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,广泛应用于化工生产,也可直接用作燃料.已知: CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H1=﹣443.64kJmol﹣1;
2CO(g)+O2(g)═2CO2(g)△H2=﹣566kJmol﹣1 .
下列说法或热化学方程式正确的是( )
A.CO的燃烧热为566kJmol﹣1
B.2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低
C.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=﹣1453.28 kJmol﹣1
D.完全燃烧16g甲醇,生成一氧化碳和水时放出的热量为221.82 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组仔细研究了硫酸亚铁铵的制备实验,并与侯氏制碱法的原理进行认真分析对比,同学们分别发表了如下看法,其中错误的是( )
A.没有难溶、难电离、易挥发物质生成的复分解反应也可能发生
B.溶液中某些离子结合成新物质析出,其根本原因是这些离子浓度的幂次积超过了该物质的溶度积常数或电离平衡常数
C.一种难溶物质或难电离物质,可以通过复分解反应生成更难溶或更难电离的物质
D.只要适当改变温度、压强、浓度,任何反应都可自发进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com