
【题目】将不可再生的天然气、石油、煤等化石燃料转化利用、提高利用率已成为当务之急.
(1)根据部分键能数据和CH4 (g)+4F2 (g)=CF4(g)+4HF(g)的反应热△H为1940kJmol﹣1 , 计算H﹣F键的键能为 .
化学键 | C﹣H | C﹣F | H﹣F | F﹣F |
键能/(kJ.mol﹣1) | 414 | 489 | ? | 155 |
(2)甲醇、二甲醚(CH3OCH3)被称为21世纪的新型燃料,二者均可利用CO和H2反应合成. ①某燃料电池以二甲醚为原料,熔融碳酸盐为电解质,其负极反应如下:CH3OCH3+6CO32﹣﹣12e﹣═8CO2+3H2O.写出该燃料电池的正极反应式 .
②废水中含甲醇对水质会造成污染,Co3+可将甲醇氧化为CO2 . 某同学以Pt作电极电解酸性含甲醇废水与CoSO4混合液模拟工业除污原理,其阳极反应式 .
(3)某企业采用如图所示原理处理化石燃料开采、加工过程产生H2S废气. ①电解池中电极A、B均为惰性电极,其中A为电解池的极;电极B所得到的物质X的分子式为 .
②反应池中发生的离子反应方程式为 . 
【答案】
(1)565kJ?mol﹣1
(2)O2+4e﹣+2CO2=2CO32﹣; Co2+﹣e﹣=Co3+
(3)阳; H2; H2S+2Fe3+=2Fe2++S↓+2H+
【解析】解:(1)设H﹣F键的键能为xkJmol﹣1,在反应CH4(g)+4F2(g)=CF4(g)+4HF(g)中,△H=(4×414+4×155)kJmol﹣1﹣(4×489+4×x)kJmol﹣1=﹣1940 kJmol﹣1,解之得x=565kJmol﹣1,
故答案为:565kJmol﹣1;(2)①燃料电池中,正极上氧化剂氧气得电子和二氧化碳发生还原反应生成碳酸根离子,电极反应式为O2+4e﹣+2CO2=2CO32﹣,
故答案为:O2+4e﹣+2CO2=2CO32﹣;
②通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+﹣e﹣=Co3+,
故答案为:Co2+﹣e﹣=Co3+;(3)①A极生成铁离子,B极生成气体,可知A为阳极,B为阴极,B极生成气体为氢气,
故答案为:阳; H2;
②反应池中铁离子和硫化氢反应生成硫,则铁离子被还原,离子方程式为H2S+2Fe3+=2Fe2++S↓+2H+,
故答案为:H2S+2Fe3+=2Fe2++S↓+2H+.
(1)根据反应热能与反应物的总键能减生成物的总键能计算;(2)①燃料电池中,正极上氧化剂得电子发生还原反应;
②电解池中阳极失电子发生氧化反应;(3)①A极生成铁离子,B极生成气体,可知A为阳极,B为阴极;
②反应池中铁离子和硫化氢反应生成硫,则铁离子被还原.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】有关原电池的工作原理中的下列说法中不正确的是( )
A.电池负极发生氧化反应
B.电池正极发生还原反应
C.电子流向是从负极流向正极(外电路)
D.电流方向是从负极流向正极(外电路)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已学物质结构与性质的有关知识,回答下列问题:
(1)请写出第三周期元素中p轨道上有3个未成对电子的元素符号: , 某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4 , 该元素的名称是 .
(2)根据价层电子对互斥理论推测下列离子或分子的空间立体构型:H3O+ , BF3 .
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关反应的离子方程式、 .
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A 元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料一一光导纤维,C 与烧碱反应生成含A 元素的化合物D。
(1)写出C与氢氟酸发生反应的化学方程式是_____________________________
(2)将C与纯碱混合高温熔融时反应生成D,同时还生成氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①分别写出生成D和F的化学方程式:_______________________、_________________________。
②要将NaOH高温熔化,下列坩埚中可选用的是______________________________。
a.普通玻璃坩埚 b.石英玻璃坩埚 c.氧化铝坩埚 d.铁坩埚
(3)碳还原SiO2制SiC,其粗产品中杂质为Si和SiO2。现将20.0g SiC粗产品加入到过量的NaOH溶液中充分反应,收集到0.1mol氢气,过滤得SiC固体11.4g,滤液稀释到1L。生成氢气的离子方程式为______________________________,硅酸盐的物质的量浓度为__________mol/L。
(4) 下列叙述正确的有_______(填序号)。
①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应
②Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
③钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比均为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题: 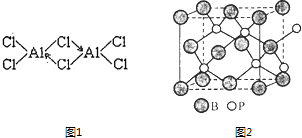
(1)写出基态镓原子的电子排布式 .
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),结构如图1缔合双分子Al2Cl6中Al原子的轨道杂化类型是 .
(3)B原子的电子有个不同的能级;晶体硼熔点为2300℃,则其为晶体.
(4)磷化硼(BP)是一种有价值的耐磨硬涂层材料,它是通过在高温氢气氛围下(>750℃)三溴化硼和三溴化磷反应制得.BP晶胞如图2所示. ①画出三溴化硼和三溴化磷的空间结构式.
三溴化硼三溴化磷
②在BP晶胞中B的堆积方式为 .
③计算当晶胞晶格参数为apm(即图中立方体的每条边长为apm)时,磷化硼中硼原子和磷原子之间的最近距离 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明:多种海产品如虾、蟹、牡蛎等,体内含有+5价的砷(As)元素,但它对人体是无毒的,砒霜的成分是As2O3,属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:大量海鲜+大量维生素C=砒霜.下面有关解释不正确的应该是
A.青菜中含有维生素C
B.维生素C具有还原性
C.致人中毒过程中砷发生还原反应
D.砒霜是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学药品与警示语对应正确的是( )
①酒精——剧毒品 ②浓硫酸——腐蚀品 ③汽油——易燃品 ④烧碱——剧毒品 ⑤氯酸钾——氧化剂 ⑥硝酸铵——爆炸品
A. ①②③⑥ B. ①②⑤ C. ①④⑤ D. ②③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com